
# 热门搜索 #
一扫阴霾?Sangamo/辉瑞公布A型血友病基因疗法早期积极数据,凝血因子水平恢复超出预期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持编者按:本文转载自医麦客,作者:陈婉仪。动脉网获授权转载。
2月7日,Sangamo公布首个在体锌指核酸酶(ZFN)基因组编辑疗法SB-913的初步数据,证明体内基因组编辑已经发生,基因组编辑的肝细胞能使亨特综合征患者产生缺失的酶— —艾杜糖醛酸-2-硫酸酯酶(IDS)。
然而,细胞中酶的增加不足以让投资者相信该疗法的设计是有效的。Sangamo还报告了Hurler综合征患者的另一项体内基因组研究结果。该公司承认结果没有达到预期,但对锌指核酸酶方法有信心。今年晚些时候将从接受更高剂量基因治疗的患者中获得更多数据。
这是Sangamo近十年来股价遭遇的最大挫折,下跌超过30%,其他几家以基因编辑为重点的公司的股价也暴跌8%-9%。

4月2日,Sangamo及其合作伙伴辉瑞公布研究性A型血友病基因疗法的1/2阶段临时数据。数据显示,SB-525一般耐受良好,并且在4个剂量组中证明了凝血因子VIII(FVIII)水平的剂量依赖性增加。总共有8名患者接受了治疗。基于这些结果,安全监测委员会(SMC)建议以3e13 vg/kg剂量进行队列扩大。
在数据公布当天,Sangamo早盘交易股价飙升45%,创下2017年5月以来的最高单日涨幅,达到约5个月来的最高水平,收盘28.96%;合作伙伴辉瑞的股价也逐渐上涨。
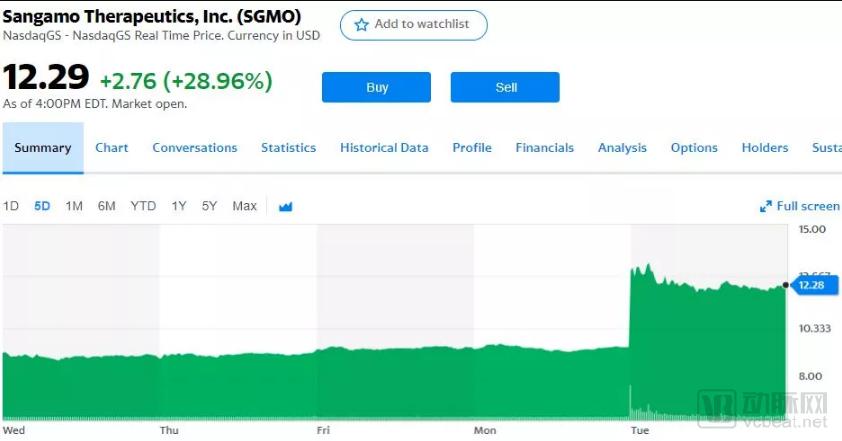
瞧这刺激的波浪!(图片来源:Yahoo)
“Alta研究中使用SB-525基因治疗的前8位A型血友病患者的临时数据令人鼓舞,并证明剂量依赖关系、持续因子水平和低变异性,在患者和队列之间均是如此。“Sangamo的首席医疗官Edward Conner博士说。“这些临时结果表明,SB-525可能具有良好的耐受性,可能具有可预测性和持续治疗效果,为A型血友病患者带来临床益处。“
SB-525是重组腺相关病毒血清型6载体(AAV6),其编码B结构域缺失的人FVIII的互补脱氧核糖核酸(cDNA)。设计SB-525载体盒以优化载体制造产量和肝特异性FVIII蛋白表达。SB-525转录盒包含对肝特异性启动子模块、FVIII转基因、合成多腺苷酸化信号和载体骨架序列的多因子修饰。
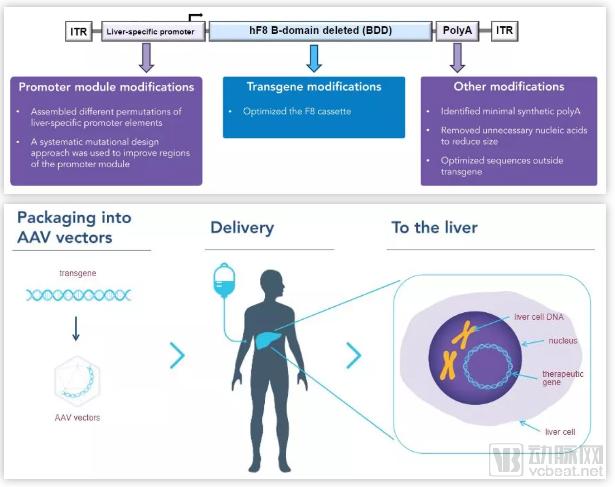
SB-525结构及治疗流程(图片来源:Sangamo)
Alta研究
包括在4个递增剂量组中治疗的8名患者(9e11vg/kg、2e12vg/kg、1e13vg/kg和3e13vg/kg,每组2名患者)。
有效性方面
患者表现出FVIII水平的剂量依赖性增加,在较高剂量组中实现FVIII活性的临床相关增加,和在最高剂量组(3e13 vg/kg)中的正常FVIII水平(正常范围: 50-150%)。
输注后第6周,2名最高剂量组的患者FVIII达到正常值的140%和94%(通过一步凝血测定法测量),93%和65%(通过显色测定法测量)。还观察到患者使用FVIII替代疗法的剂量依赖性减少,最高剂量组患者在首次使用预防因子后不需要进行因子替代疗法,并且迄今为止没有发生出血事件。
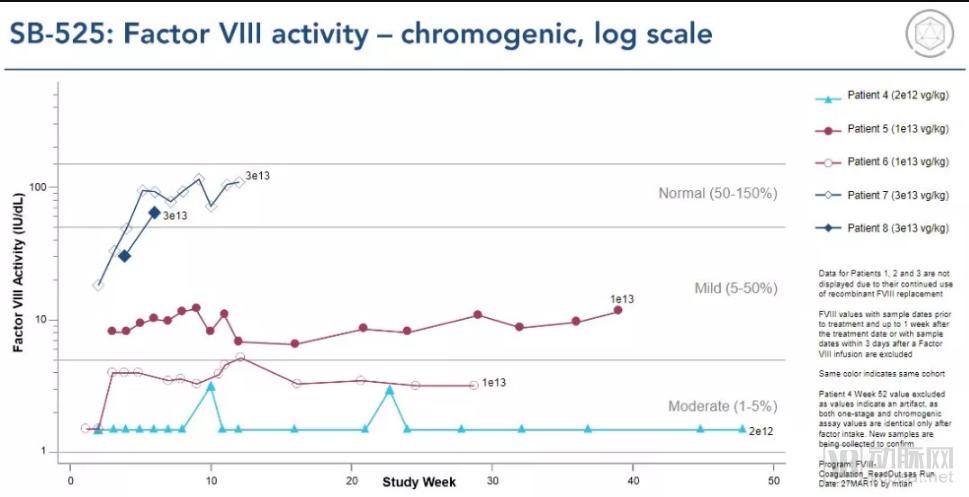
(图片来源:Sangamo)
Sangamo 4月3日的分析不包括三名患者,其中两名患者接受9e11 vg/kg剂量和一名2e12 vg/kg剂量,因为他们没有表达高于可检测范围的因子。
安全性方面
SB-525通常耐受性良好,最高剂量组中的1名受试者报告了与治疗相关的低血压和发热严重不良事件,并通过治疗得到解决。同一患者的肝酶升高超过正常上限的1.5倍,随后通过口服类固醇解决。但肝酶的增加在基因疗法中并不罕见,并且在这过程中患者没有显示FVIII活性的丧失。
Alta研究中的患者未接受预防性类固醇治疗。在前三个队列中没有观察到与治疗相关的严重不良事件和没有需要超过七天皮质类固醇治疗的肝酶升高。
“我们对早期临床数据表示鼓舞,这些数据表明重组AAV6载体的耐受性和FVIII水平正常化的可能性。我们期待有机会扩大给予3e13 vg/kg剂量的队列,并随后进行关键性研究计划,“辉瑞公司高级疾病研究部高级副总裁兼首席科学官Seng Cheng说。“作为SB-525的开发和商业合作伙伴,我们对SB-525有朝一日可能改变A型血友病患者的治疗前景感到鼓舞。”
根据SMC推荐和研究方案,第四队列将扩展至多达5名患者。患者登记正在进行中。
对于Sangamo而言
Cowen分析师Ritu Baral写道,SB-525的消息“非常令人鼓舞”,并显示了治疗的风险/效益竞争优势。尽管患者数量少且随访时间相对较短,使得反应的持久性仍是一个悬而未决的问题,但FVIII表达水平与竞争对手相当,变化不大。同时,良性安全性也可以为其提供竞争优势。
罗氏公司在2月份表示将以48亿美元的价格购买Spark Therapeutics,后者处于A型血友病基因疗法SPK-8011的3期开发。
SPK-8011使用Spark200,一种生物工程AAV衣壳,经过优化,可更有效地转导肝细胞,并含有优化的B结构域缺失的FVIII表达盒。在1/2期试验中,12名A型血友病患者接受了SPK-8011的治疗,截至2018年11月2日,无抑制剂、无血栓形成事件以及没有持续或未解决的转氨酶升高。在所有三种剂量中,从载体输注后第四周开始,年出血率减少了94%,FVIII输注需求减少了95%。
令人担忧的是,其中7名患者接受了口服类固醇反应性逐渐减少的疗程,包括低剂量组(2e12vg/kg)中的5名。所有受试者对载体输注作出反应,其中FVIII的循环水平增加。2e12 vg/kg组中的2名受试者具有可疑的衣壳免疫应答,导致其FVIII水平下降至低于5%。其中1名受试者对口服类固醇没有迅速反应,并且选择性地入院接受两次静脉注射甲基强的松龙注射液。该事件随后解决,除了FVIII活性的降低之外没有持续的有害影响。这些输液的入院符合严重不良事件的标准。
预计该公司将于2019年中期提供1/2期研究的进一步更新,其中包括额外的2e12vg/kg剂量组,每组5至10名受试者使用来自我们的悬浮液制造工艺生产的产品,并将评估预防性而不是反应性类固醇给药方案,以减少或消除免疫反应为目标。
围绕SPK-8011的免疫原性问题仍有待解决,扩展研究的数据将至关重要。Spark公司新的制造工艺能否提高其产品的安全性,我们拭目以待。
与此同时,另一名竞争对手BioMarin的valoctocogene roxaparvovec(valrox)正在进行3期临床试验。该公司是第一家为A型血友病开发基因疗法的公司,valrox此前已获得美国FDA授予的突破性疗法认定,并被NEJM的独立社论称为“治愈血友病的方法”。
上述候选基因疗法机理类似,均是使用AAV载体将FVIII基因的功能性拷贝转移到患者体内。但根据目前的数据,相对于SPK-8011,valrox的临床数据更加吸引。
在名为GENEr8-1的1/2期临床试验中共有40名A型血友病患者,6e13 vg/kg剂量下,该疗法能够将患者平均年出血率降低97%,而且截止治疗104周,患者FVIII用量平均减少96%,FVIII活性水平在59%的正常范围内,并且中值接近正常水平为46%。此外,valrox表现出良好的耐受性,没有患者产生对外来FVIII的抑制剂,也没有患者退出临床试验。
然而,valrox也存在关于耐久性的疑问。去年5月,在英国格拉斯哥举行的世界血友病联盟(WFH)会议上报告的1/2期试验数据显示,在2年时间节点时,最高剂量组(6e13 vg/kg)相对于ASH报告的FVIII表达水平下降明显。这种担忧可能会持续到该公司今年提供3年数据之时。
Sangamo投资者无疑希望最新的SB-525可能会比SPK-8011和valrox更好。
然而,Sangamo的项目仍有很长的路要走:在第三阶段开始之前,将在Alta研究中使用高剂量治疗3至5名患者。还需要更长期的数据来确定SB-525的耐久性。
辉瑞公司负责后期开发,Sangamo高管在电话会议上指出,其合作伙伴将决定使用何种剂量的SB-525进行关键性试验。根据协议,Sangamo有资格获得4.75亿美元的里程碑,3亿美元与SB-525相关。
对于辉瑞而言
除了A型血友病基因疗法的布局,辉瑞正在推进Spark公司B型血友病基因治疗计划,并负责启动3期临床试验。
根据协议条款,辉瑞将独自承担与B型血友病基因治疗计划相关的任何产品的临床研究、监管事宜、生产及全球商业化。根据clinicaltrials.gov,该公司正在招募患者进行为期6个月的“引入(lead-in)”研究,该研究将作为随后的3期临床试验对照组的一部分。
同日,Sangamo公布与赛诺菲合作开发的ST-400用于β地中海贫血的早期数据,这是一种基于ZFN基因编辑的体外基因疗法。
数据处于相当早期,但该数据或是ZFN技术离体编辑细胞基因组能力的坚实概念验证。
第一名输血依赖性β地中海贫血患者在1/2期试验中接受ST-400治疗,数据显示成功编辑了负责该疾病的基因。输注后,患者表现出血红蛋白水平升高,并在短暂(约2周)接受定期输血后,不依赖输血。患者经历了严重但短暂的过敏反应,该反应与产品中的冷冻保护剂有关。这似乎是个体反应而不是与治疗有关。
4月2日,Sangamo宣布与基因治疗合同开发和制造组织(CDMO)Brammer Bio签署协议,以确保大规模AAV制造。近日,赛默飞宣布将以17亿美元收购后者。
此外,Sangamo正在建设位于加州布里斯班的新设施,即1/2阶段cGMP制造工厂,预计将于2020年投入运营。
与Brammer Bio达成的协议为Sangamo提供了高达2000L生物反应器规模的专用AAV制造能力,能够处理ST-920等产品的大规模商业化运行,ST-920是Sangamo的法布里病基因治疗产品候选产品。该协议还允许Sangamo在布里斯班的新工厂利用Brammer Bio的病毒载体制造技术,以提供从早期开发到后期临床试验和商业规模制造的无缝过渡。
相信近两个月来,基因编辑公司Sangamo已经尝尽冷暖,最新的股价上涨弥补了之前的损失,而在真正获得基因疗法的成功之前,还必须治疗更多的患者,展示长期数据。
参考出处:
https://investor.sangamo.com/news-releases/news-release-details/sangamo-and-pfizer-announce-phase-12-interim-data
https://www.bloomberg.com/news/articles/2019-04-02/sangamo-soars-as-hemophilia-gene-therapy-results-quiet-bears
https://www.biopharmadive.com/news/sangamo-setback-pulls-down-gene-editing-biotech-peers/548024/
https://medcitynews.com/2019/04/sangamos-shares-skyrocket-on-early-gene-therapy-data-in-hemophilia-beta-thalassemia/?rf=1
https://www.evaluate.com/node/14551/amp?__twitter_impression=true
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。