
# 热门搜索 #
MAH制度全面落实,澳斯康生物制药如何抢占CDMO发展良机?
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持2019年8月26日,第十三届全国人大常委会第十二次会议上,新修订《药品管理法》审议通过,将于今年12月1日起施行。
值得注意的是,新修订的《药品管理法》明确,国家对药品管理实施药品上市许可持有人制度(MAH制度),上市许可人依法对药品研制、生产、经营、使用全过程中药品的安全性、有效性和质量可控性负责。MAH制度的全面落实,对于澳斯康生物制药等CDMO企业来说,无疑是迎来了发展良机。

澳斯康生物制药地处江苏省海门临江新区(图片由企业提供)
作为一家成立于2017年的年轻公司,澳斯康生物制药在2019年年初完成超3亿元的A轮融资,一跃成为CDMO行业的新起之秀。CDMO行业如何兴起?国内市场情况如何?在MHA制度的东风之下,澳斯康生物制药将如何博得先机?据此,动脉网对澳斯康生物制药创始人兼董事长——罗顺博士进行了专访。

罗顺博士:美籍华人,顶级专家,澳斯康生物制药、健顺生物创始人(图片由企业提供)
早期,生物制药企业大都是自主研发、生产药物。到了上世纪80年代,许多国家都将生物技术行业作为优先发展的战略产业,纷纷制定发展规划。例如,美国将生物医药行业作为经济增长点,实施生物技术产业积极政策;日本确定了“生物产业立国”战略;欧盟科技发展第六个框架将45%的研发费用用于生物制药领域等。
在各国战略的推动下,制药公司也越来越追求高效率、低成本的生产工艺,开始将诸多生产和销售业务进行外包,降低厂房生产投资风险,自身运营成本,增强竞争力。此时,CMO(合同加工外包)企业应运而生。CMO通过接受药企委托,为药品生产设计的工艺开发、配方开发提供支持,主要涉及临床用药、中间体制造、原料药生产、制剂生产以及包装等定制生产制造服务,按照合同的约定获取委托服务收入。
制药企业对于效率和成本的追逐没有终点,并且,随着药企的研究重点从小分子药物转向大分子药物,仅仅提供代工生产服务的CMO企业已不能满足要求,具有高技术服务输出能力的CDMO企业逐渐受到青睐。
CDMO企业在为制药企业提供生产服务时,可用自身技术对整个研发生产过程进行优化,帮助药企开发或改进工艺,提高生产效率,降低制造成本。与传统CMO业务模式相比,CDMO业务技术创新、项目管理等综合壁垒更高,能够提供从临床前研究到商业化生产的一体化服务,更符合未来发展趋势。
目前,全球CDMO订单呈现出逐渐向新兴国家转移的趋势。欧美国家CMO/CDMO市场份额从2011年的76.87%下降到2017年的70.64%。而中国、印度等新兴市场国家市场份额在持续提升,2017年中国CMO/CDMO的市场份额达到7.91%。根据RootsAnaylsis的测算,到2028年,亚太CMO/CDMO的市场份额将达到34%。
与欧美相比,中国的CDMO市场起步较晚,但是发展潜力巨大。2015年,我国开始在10省市试点MAH制度;2017年10月,国家药监局发布的《中华人民共和国药品管理法修正案(草案征求意见稿)》明确了实行MAH制度;2019年8月,MAH制度全面落实,更是激发了国内新药研发的热情。
与此前药品上市许可和生产许可捆绑的模式而言,MAH制度分离了上市许可与生产许可,使得CDMO企业具有了承接生产订单的资质,也使得没有生产资质的研发机构得以通过CDMO企业完成生产。
政府相继出台的各种政策促使我国医药行业迅速发展,越来越多的人才开始在生物制药领域创业,与之配套的CDMO企业,也迎来了发展时机。2015年11月,皓阳生物在杭州成立;2017年3月,澳斯康生物制药在江苏海门成立,2017年6月,苏桥生物在江苏成立;2018年3月,恺佧生物成立……
在融资方面,近年来CDMO企业的融资金额也十分惊人,这一点我们可以从2019年部分CDMO企业的融资情况中看出来。
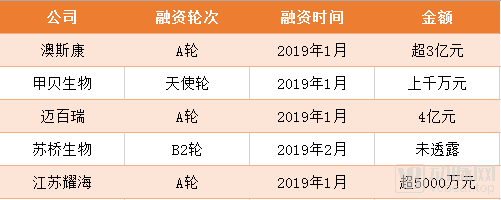
动脉网制图
动脉网了解到,大多数公司融资所得都是用于购买仪器和设备,这也推动了仪器设备和耗材公司的发展,使其赚得盆满钵满。目前我国的CDMO企业在仪器设备、耗材以及培养基开发方面,大部分依赖国外进口。但是有一家CDMO企业率先打破垄断,实现了优质细胞培养基原材料、工艺技术开发、一次性反应器设备及耗材的有机整合,这家企业就是澳斯康生物制药。
澳斯康生物制药由罗顺博士创立,旨在为中国生物制药研发提供产业化服务。而澳斯康生物制药之所以能打破国外企业在生物制药仪器、培养基方面的垄断,就不得不提及罗顺博士创立的另一家公司——健顺生物。
罗顺博士曾在世界著名无血清细胞培养基生产公司JRH负责产品研发及大规模生产。在基因泰克工作期间,罗顺博士建立了全自动、高通量抗体及蛋白药物中试生产优化平台。在安进,罗顺博士领导的CHO细胞培养中试部以其在业内最高的药用蛋白产量而闻名。2011年,罗顺博士回国,创立了健顺生物,专注于从事无血清细胞培养基及相关技术产品的研发及生产。
无血清细胞培养基是生物药研发最关键的原材料之一。生物制药产品一定要有培养基来供其生长。培养基的成分不能随意更改,一个细胞株在同样的工艺条件下中,如果少了或多了某种成分,会导致目标产物的表达完全不同。
罗顺博士说:“我回国之前,中国没有一家从事无血清细胞培养基开发的公司。”健顺生物的产品和技术填补了中国无血清细胞培养基的工业化技术空白。如今,健顺生物已成为中国无血清细胞培养基的龙头老大。
2015年,MAH制度开始试点,罗顺博士意识到,CDMO企业的发展机会已来。于是,澳斯康生物制药自然而然地诞生了。
除了健顺生物特有的无血清个性化培养基,澳斯康生物制药运营模式同步创新,整合了和拥有自主知识产权的细胞培养设备、激流式一次性生物反应器、一次性耗材及配液、转运等其他仪器设备资源,打破了CDMO依赖国外仪器耗材企业的局面,成为真正做到从DNA到IND一站式、低成本高效率的解决方案提供者。
澳斯康生物制药致力于打造中国生物制药行业集原材料供应、技术服务、合同生产于一体的行业领军企业,拥有生物制药行业顶尖团队,可为客户提供“研发-工艺技术-生产-物流-技术支持-售后”个性化的,全产业链的定制服务,包括细胞株开发、培养基优化、细胞培养工艺开发、纯化工艺开发、制剂工艺开发、检测分析方法建立优化、检测外包服务、中试非GMP及GMP级别生产用于临床前及临床研究样品、协助注册申报、全产业链技术咨询等。

图片由企业提供
罗顺博士表示:“CDMO企业的竞争焦点在于如何提高效率,降低成本。无法打破外企在无血清培养基和一次性反应器及耗材方面的垄断,中国CDMO企业就无法将成本降到最低,也就无法与国外CDMO企业竞争。”
成立不久,澳斯康生物制药就开工、投产,投产速度远远快于同期成立的CDMO企业。目前,澳斯康生物制药已和众多知名药企建立合作关系,多个临床前、一期、二期和三期临床项目正在进行中,行业口碑甚好。
谈及目前全球CDMO行业竞争格局,罗顺博士按照市场占有率、公司规模、技术竞争力方面将CDMO企业分为三个梯队。CDMO龙头企业Lonza、BI当之无愧地属于第一梯队。目前,尚未有中国企业进入第一梯队。但罗顺博士表示:“我相信,未来第一梯队一定有澳斯康生物制药的一席之地。”
然而,想要在全球CDMO行业崭露头角并非易事。罗顺博士说到:“目前生物制药行业仍然是欧美的主战场,Lonza、BI等CDMO企业与国外老牌生物制药公司有着千丝万缕的联系,国内CDMO企业,只能依靠降低成本并且提高生产效率,成为真正的‘中国创造’,才有望与全球老牌CDMO企业竞争,进而与全球生物制药公司合作。”
中国在降低成本方面有着得天独厚的优势。罗顺博士表示:“在欧美生物制药行业,每克蛋白的生产成本在300至400美金,澳斯康生物制药通过整合优质的中国制造培养基和一次性反应容器,将不断挑战生产成本极限。”
“在同等的质量和效率下,国内外生物制药公司自然会被更低的制造成本吸引。未来,国外生物制药公司会像苹果公司离不开中国富士康一样,离不开澳斯康生物制药。”罗顺博士自信地说到。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。