
# 热门搜索 #
用Biomarker拯救“临床失败药物”,这家中国公司另辟蹊径开发全球的First in Class
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持罗文博士在与越秀产业基金的投资人见面之前,已经与不少的投资机构进行过交流。一开始,国内投资人都对他的创业思路和模式充满疑问。“你们就这么确定能顺利的找到Biomarker?”“跨国药企都搞不定的事情你们能搞定?”这些问题在罗文耳边萦绕。罗文对自己一手创办的企业心知肚明。他们的技术没问题,礼来的药也已经拿到了授权,现在就差资本的支持来推动Ⅲ期临床工作。
在短暂的寒暄之后,越秀产业基金的投资人抛出了他对索元的第一个问题:“你当时为什么会选择从开发‘失败药物’的角度创业?”这不是罗文第一次听到这个问题,很多人都很好奇他在创业方向上的选择。虽然已经有生物标记物改变易瑞沙命运的成功案例,但是在索元生物之前,并没有人把“临床失败药物”的开发当成一个商业模式来做。
罗文在Ligand Pharmaceuticals工作的时候,公司曾有一个临床Ⅲ期未通过的药物。如果是在跨国药企,通常这样的药物直接就被放弃了。然而对于Ligand这样的中型生物技术公司来说,还是希望保留这条药物管线。于是在罗文的主导下,Ligand开发了一个寻找Biomarker的平台技术,并且通过该平台成功找到了该药的Biomarker。
然而,Ligand在纳斯达克已经上市近20年却仍保持未盈利状态,在资本市场推动下,公司经历了大规模重组,该药也被卖给了卫材药业。公司拆解和药物卖出的这段经历,让罗文确信他开发出的Biomarker的平台能帮助临床失败的药物得到价值重建。在Ligand被收购后,罗文将该Biomarker平台技术以职务发明买出,并成立了索元生物。
这个故事罗文已经对投资人们讲了很多遍,但面前这位投资人的反应似乎和此前的听众们不太一样。他稍微停顿了几秒,娓娓道出了自己的故事:“我在国外任职的第一家公司也是做医药研发的。我们当时有个临床Ⅱ期的项目,那是我们公司唯一的项目。项目结果出来的前一天我们把香槟都已经准备好了。我们当时有充分的把握,觉得这个临床肯定是成功了。结果第二天临床结果出来之后是negative。到了第三天的时候公司人都走光了,连办公用品都已经被搬完了。”
“虽然我当时只是公司里的一个小角色,但是这件事情给我的触动非常深。我从来没有意识到过传统新药研发的模式风险这么高。只是因为一个临床试验的失败,一个公司多年的投入,大量参与试验的医生、患者多年贡献的宝贵临床数据,还有该药和这个新靶点相关的研发经验就都浪费掉了。所以我很钦佩您正在做的事情,而且也很看好索元未来的发展前景。”罗文感受到了与这个资深医药投资人的共鸣。他认为这些临床失败的药物管线不该就此被束之高阁。只要有合适的Biomarker助力,很多临床失败的药物都能找到适合自己的治疗人群。
这正是索元生物成立六年以来正在做的事情。索元生物聚集了一帮医药行业的经验丰富的元老,通过从其他药企手上收购临床失败的药物管线,利用自己独特的Biomarker发现平台,帮助“失败药物”精准定位患者群体,进而在精准人群中重新进行临床试验,最终让这些“失败药物”重获新生。
对于所有的靶向药,无论是小分子化药还是大分子抗体药,这些药物最初设计的分子构型就决定了它们可以与特定的靶点结合并因此起效。
但是人体内的情况过于复杂,药物在实际使用到患者身上的时候可能会产生不同的效果。有部分药物可能会由于患者内环境的原因,使得药物与靶点结合的效率不够高,最终导致这部分药物在预先设计的目标人群当中的有效率不足,无法通过临床试验。对于这部分药物而言,它们的适用患者群体可以通过合适的Biomarker进行分选。因此如何为这些药物找到合适的Biomarker就成了问题的关键,这也是精准医疗的核心所在。
历史上有一款著名的药物就曾在Biomarker的助力下突破困境。阿斯利康的易瑞沙(吉非替尼)最早于2003年获FDA加速批准。阿斯利康按规定继续进行了一项1700人规模的临床Ⅲ期试验。然而该临床试验却在2004年底宣告失败。
根据FDA的加速审批计划,如果上市后临床研究未能验证临床获益,FDA有权从市场上撤回该药物。所以该项临床试验的失败将易瑞沙推到了生死存亡的边缘。阿斯利康内部花了很多的精力试图寻找易瑞沙的Biomarker。尽管这是阿斯利康研发的药,他们自己也并没能找到合适的Biomarker。最终还是在两位哈佛大学教授的协助下才成功的找到了EGFR突变可以作为Biomarker筛选有效人群,最终使得易瑞沙重获新生。而因此得以幸存的易瑞沙,时至今日仍然是肺癌患者的最佳选择之一。
阿斯利康都没搞定的事情,索元生物居然想做成产业,这中间的关键就在于罗文是少数既有深度基因组学及生物信息学研究经验,又实际全程参与药物研发的人。罗文在20多年前就加入了以激酶抑制剂闻名的企业Sugen(后被辉瑞收购,辉瑞有很多肿瘤药物管线都来自Sugen,其中包括著名的舒尼替尼)。
2000年,人类基因组计划完成后,罗文加入了当时全球最大的基因组学公司——Incyte Genomics,并在Incyte参与了大量基因组学、蛋白组学的大数据项目。这些独特的背景使得他可以在Ligand主导Biomarker平台的研发过程,对于Biomarker平台推动新药研发的优势所在了如指掌。
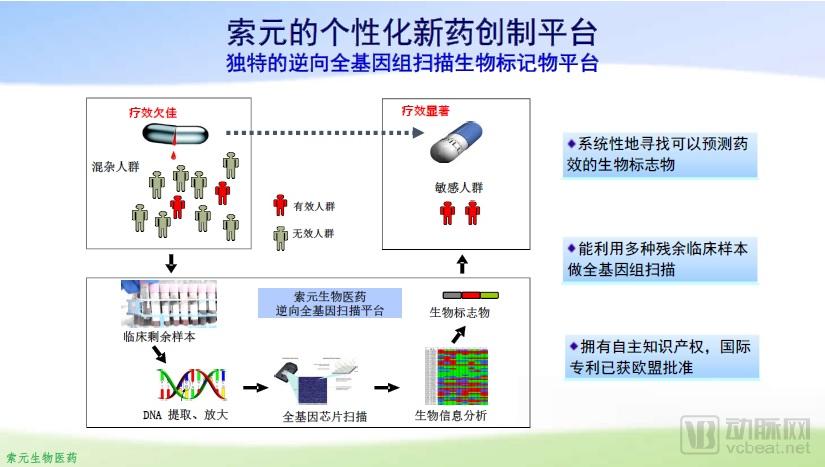
索元生物的生物标记物开发平台
在Biomarker平台的分析过程中,首先要对留存的临床试验患者样本进行全基因组扫描,以了解各个患者的SNPs(单核苷酸多态性)。然后根据患者的临床疗效将患者分类,通过比对有效人群与无效人群之间的SNPs差异,筛选出有效患者的药敏基因型。在找到“合适人群”后,在进一步的临床试验中,索元生物就可以精准定位这部分患者,并期待在药物治疗中表现出更高的有效率。如此一来,既可以减少因治疗无效而耽误治疗过程的入组患者,又可以提高临床试验的有效率,可谓是一举两得。
基于全基因组扫描的Biomarker平台,其运行需要通过药物临床试验得到的大量患者样本。这也就意味着这一平台只适用于已经进入Ⅱb或Ⅲ期临床试验的药物。因此索元的商业模式是直接由这一平台的运行机制决定的。也只有这种针对“失败药物”的商业模式,才能将Biomarker平台的价值最大化。
索元生物的商业模式决定了他们将要从一个全新的角度去切入药物研发产业,而不是单凭自己的力量从头做起。大多数生物医药企业成立之后的第一件事情都是制定产品路线。但是对于索元生物而言,他们要做的第一件事情是买药。
索元生物创建时,他们曾想以CRO的身份为药企提供分析服务。但在与药企的深度接触之后,他们发现让药企直接为“失败药物”付费是件几乎不可能的事情。初创药企一条管线的失败可能就直接让企业土崩瓦解。这些企业没有精力,可能也没能力再继续为这些“失败药物”付费。而大药企的临床管线很多,一条管线一旦失败,就会立刻被放弃。
另外,索元生物的Biomarker开发服务过于前沿,很难一开始就获得药企的信任。这一系列原因反而推动他们选择了一条风险更高,同时也意味着机会更大的路线——收购药物自行主导药物研发。由于这种做法的起点是已经进入Ⅱb或Ⅲ期临床的新药,因此索元生物的研发周期远远短于传统新药研发所需的10-15年。
索元生物瞄准的第一款药,就是当年Ligand临床失败的Targretin(Bexarotene)。这款药物是整个故事的开端,也是罗文一直以来在心中的一个结。Targretin在2006年10月被Ligand出售给了日本的卫材药业。而卫材药业又将这款药物的日本商业权利出售给了一家日本的制药公司Minophagen。
Targretin早在Ligand手上的时候就已经获批了一项适应症,用于复发或难治性CTCL(表皮T细胞淋巴瘤)。虽然这是个非常小的瘤种,但是由于Targretin已经在全球数十个国家推出,年销售额也达到了数千万美金,所以这款药物的价格是刚刚起步的索元生物无法负担的。因此在详细的调研之后,罗文只好放弃了Targretin。但是他们仍然把DB101这个管线编号留给了Targretin,既作为一种回忆,也是一种激励。
放弃了Targretin之后,索元生物开始寻找其他合适的药物管线。而这时礼来的Enzastaurin进入了他们的视野。礼来在2013年5月宣布,由于此前Enzastaurin在一项后期临床试验上的失败,礼来将停止该药物的开发。
Enzastaurin是一款小分子靶向药。在停止开发之前,礼来已经为这款药物投入了上亿美金,开展了60多个临床试验,有3000多名患者服用过这款药物。并且礼来作为全球顶尖的制药企业,其临床数据的质量也非常有保证。
这样一款临床数据充足的“失败药物”简直是为索元生物量身打造。因此索元生物在礼来宣布停止开发之后就迅速与礼来接洽,想要收购Enzastaurin。虽然是已经放弃的药物,但是礼来在与索元的合作上还是表现得很谨慎。
一是索元生物的商业模式礼来闻所未闻,二是上亿美元的投入和十几年的研发成果就此拱手让人,即使对于礼来这种体量的公司而言,也是个很难做出的决定。但是礼来最终还是选择了相信索元生物。
2014年9月,在礼来宣布停止开发Enzastaurin 16个月之后,索元生物获得了Enzastaurin的全球权益。从此Enzastaurin也摇身一变,变成了索元生物的DB102。
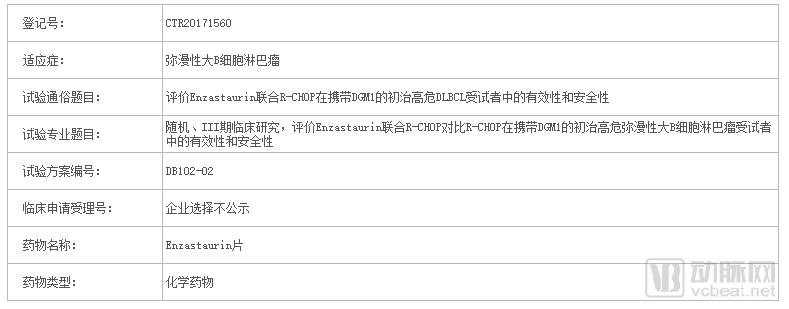
DB102在国内登记的临床试验信息
随后索元生物迅速地展开了对DB102的Biomarker探索。在对礼来收集的留存样本和临床数据进行的分析之后,索元生物发现了一个全新的Biomarker,并将其命名为DGM1(Denovo Genomic Marker 1)。DGM1阳性的患者对DB102治疗的应答率更高,也就是说DGM1与DB102药物疗效有较强的相关性。
明确了Biomarker之后,DB102的第一个临床试验设计与准备随即展开。2017年10月,索元生物在中美两国申报的DB102治疗弥漫性大B细胞淋巴瘤国际Ⅲ期临床试验ENGINE研究,同时获得了两国药监管理部门的批准,并在数月后达成第一例受试者入选,目前在积极入组阶段。
DB102随后捷报频传。先是2018年6月斯坦福大学的研究团队发现了DB102的新适应症肺动脉高压。然后在2018年底,DB102与BTK抑制剂联用增效的发现被中国临床肿瘤学会和美国血液学年会接受。2019年5月,DB102治疗胶质母细胞瘤的Ⅱ期临床试验也在美国提交申请。如果DB102任一临床试验最终顺利达成预设研究终点,那么它将成为国际生物医药领域的重磅药物,成为来自国内的First in Class。
索元生物国内临床负责人韩滢滢告诉我们,DB102的国际多中心试验ENGINE研究全球第一个患者是在国内入组的。DB102现在国内的患者入组速度甚至比美国还要快。
“我们真的是赶上了好时候。临床审批加速为我们带来了极大的便利。DB102在中美两地的临床批件我们几乎同时拿到,这在以前是不可想象的。以前国内的临床试验比国外滞后得多。现在我们可以充分利用国内的临床资源,让国内的患者也可以第一时间用上像DB102这样First in Class的新药。”韩滢滢说。在临床试验中,北京大学肿瘤医院的淋巴瘤领域权威朱军教授及各家研究单位也对于索元模式非常认可,并给予了很大的支持。
在赴美攻读博士前,罗文在8年制的协和医学院学习临床医学。但是当他发现即使医药行业发展至今,仍有许多病种,例如某些恶性肿瘤或是精神疾病,还没有合适的药物可以用于治疗。
如果没有有效药物,即使医生水平再高,也只能是束手无策。因此罗文未等到完成协和的8年学业,就毅然决然选择赴美深造分子生物学和生物化学。他坚信唯有研发出新药,才能拯救更多的病人与家庭。随着索元在DB102与DB103上先后达成突破性进展,公司陆续接到不少国内外病友或是家属关于DLBCL、脑胶质瘤、及精神分裂症用药或是临床计划的深切关注,并表达了加入临床试验的强烈愿望。病人对于新药的渴求,成为索元团队坚持不懈,着力推动创新药问世的信念。
罗文在从Ligand取得了Biomarker平台后,就找到了他在圣地亚哥的好友——方向明博士,邀请她与自己一同创业。方向明博士是一位连续创业人,有Ph.D和M.D双博士学位。她在MD安德森癌症中心完成博士后研究之后就进入了医药产业,先后任职于多家生物技术公司,有超过20年的生物医药研发和产品开发经验。方向明选择加入索元生物的关键就在于Biomarker的平台技术和基于此平台的独特商业模式。作为一名职业年龄超过20年的生物医药老兵,她相信自己对这一平台潜力的判断。
为了更好地与药企进行沟通,罗文又找到了他在Ligand的旧友Micheal Haller博士出任公司的首席商务官。Micheal Haller曾在麦肯锡供职多年,为多家世界五百强企业服务,提供复杂医疗保健难题的解决方案。离开麦肯锡之后,Micheal Haller先后在多家生物医药企业担任商务要职。在Halozyme工作期间,Micheal Haller负责该公司与罗氏制药和Baxter Healthcare的合作关系,并促成了贺癌平、美罗华、HyQvia等多款药物的上市。
在推动DB102临床试验开展的过程中,2016年9月,索元生物邀请到了韩滢滢女士出任中国区负责人。韩滢滢在药物研发领域工作多年,曾在勃林格殷格翰、阿斯利康、爱可泰隆和麒麟医药等跨国药企任职。
加入索元生物之前,韩滢滢在科文斯工作八年,担任临床研发部中国区运营总监及负责人。她刚加入科文斯的时候,公司尚未全面拓展其在国内的业务。她一手带领了科文斯在国内整个临床运营团队的建立、扩充和管理,业内知名。在韩滢滢加入索元生物之前,团队的主要成员都在美国。邀请韩滢滢加入,正是希望借助她的经验,搭建一支充分了解国内环境的实干临床团队,以充分利用国内临床资源,为全球研发加速做出卓越贡献。
由于索元生物独特的临床模式,他们开展的第一个临床试验就是Ⅲ期临床。对于索元这样一个初创企业来说,开展Ⅲ期临床试验需要一位CMC(化学、生产和质量控制)经验丰富的老将挂帅。因此,索元生物请来了卢小雄博士担任CMC专家顾问,并于2018年2月正式加入团队担任首席技术官。卢小雄博士有超过30年的生物医药领域从业经验,曾在Arena Pharmaceuticals和Balance Therapeutics出任技术运营部副总裁,对药品的CMC非常熟悉。卢小雄博士的加入补全了索元生物在CMC方面的不足,让索元生物对后续的临床试验又多了几分把握。
2019年1月,已经聚集了多名医药行业老兵的索元生物又迎来了一位重量级人物——首席医学官张磊博士。张磊博士加入索元前任职新基制药全球执行医学总监和计划负责人,并曾在礼来、诺华等多家跨国药企负责临床试验医学注册和上市工作。在新基制药10余年任职期间,张磊曾负责明星药物Revlimid治疗套细胞淋巴瘤的上市许可。
更关键的是,张磊还是Revlimid治疗弥漫性大B细胞淋巴瘤全球Ⅲ期临床试验的负责人。而DB102目前正在开展的国际多中心Ⅲ期临床试验正是针对该适应症。张磊对这一领域的深度理解和一手经验让索元生物如虎添翼。
索元生物的管理团队聚集了这样一群平均从业时长超过20年的生物医药菁英,这显得与当下很多领域初创团队管理层逐渐年轻化的时代格格不入。年轻人确实更有冲劲,但在药物研发领域,老兵们的经验却是千金难买。尤其索元生物选择了一条独特的商业模式,这种模式要求他们的团队能越过临床前和早期临床阶段,直接接入药物研发的Ⅱ/Ⅲ期临床过程中。
年轻人的冲劲虽好,但在这重重险阻的事业上,老兵们的经验更能带领索元生物渡过一个又一个的难关。

索元生物的临床管线
2015年,DB102之后,索元生物再次从礼来引进药物,这次是精神分裂症药物Pomaglumetad,索元药物编号DB103。DB103在此前的Ⅱ期临床试验中表现良好,但后来折戟于Ⅲ期临床试验。礼来为该药开展了37个临床试验,参与受试患者达3800多人。
索元通过对该药的既往临床试验进行了回顾性分析,已经发现了一个疗效显著的病人亚组。DB103申报的国际多中心临床试验申请获得了NMPA的批准,并已于2019年正式启动前瞻性临床试验研究。
2017年,索元生物又与百时美施贵宝/AMRI达成协议,引入Liafensine,一款治疗重度抑郁症的三靶点药物。目前重度抑郁症的治疗手段还很有限。虽然强生的艾斯氯胺酮鼻喷剂Spravato在今年2月获批,但是其严重的副作用和氯胺酮的成瘾性还是令Spravato饱受争议。
“目前重度抑郁症领域的化药表现都不是很好。其实不止是抑郁症领域,整个精神类疾病的治疗上,都存在着类似的问题,包括精神分裂症。我们觉得现在精神类疾病已经到了黎明前的黑暗。十年前的恶性肿瘤也曾经面临同样的困境。但是像PD-1、EGFR、HER2等等这些Biomarker的靶向药出来之后,现在的肿瘤治疗已经大为改观。我们相信Biomarker在精神类疾病的治疗上,也能起到同样的作用。”罗文说。
索元生物目前主要专注于肿瘤领域和精神类疾病领域。“索元的商业模式决定了他们一定要做大病种。”一位索元生物的投资人这样告诉我们。索元要去做First in Class,而且又是此前经历过临床试验失败的药物,这已经意味着比较大的风险。关注小病种意味着市场空间更小,风险更大。而且他们的目标患者群体要经过Biomarker的筛选,本身就会缩小适用的患者范围。因此对于目前的索元生物来说,关注大病种是他们的必然选择。
国产新药在过去几年发生了井喷式的增长,也涌现了大量主攻生物医药的企业。但在繁荣背后,这个冉冉升起的行业也暴露出了明显的问题。国内新药项目大部分是Me too和生物类似药。
Me too虽然看起来比First in Class的风险要小得多,但是Me too的药物的赛道往往会发生拥堵。一旦没跟上先头药物的节奏,Me too药物的研发投入也会同样付诸东流。
比如目前国内的PD-1单抗赛道,现在已经有近20种不同的药物竞逐,其中6种已上市或提交了上市申请。目前已经上市的药物占据着先发优势,留给那些仍在临床前或Ⅰ/Ⅱ期临床PD-1单抗的机会已经很小。但对于First in Class的药物,就完全不存在这样的市场问题。
投资人在这件事情上的思考更多的是基于回报率。Me too药物看起来已经有了成熟的市场,回报率成果会更加稳定。但是对于First in Class的药物而言,虽然研发风险较高,但是高风险对应的是超高的回报。因为真正的First in Class面对的是全球市场,市场大小可以达到国内市场的二十倍以上。而且第一个上市的同类药品会凭借先发优势,占据大部分的市场份额。
比如索元的DB102如果顺利上市,预计销售峰值可达30亿美元。这是国内产品从来没有达到过的市场空间。因此First in Class药物以其超高的发展空间,同样值得投资人们关注。
一个重磅First in Class的新药临床Ⅲ期结果出来后,这个药物管线或者企业都有可能很快被大药厂以高价收购。比如礼来80亿美金收购Loxo,新基70亿美金收购Receptos。而且从现在的趋势上看,大药厂收购步伐正在逐步提前。前不久默克刚刚以20亿美金收购了完成临床Ⅰ/Ⅱ期的Peleton。这样的情况意味着关注新药的投资者们也应该考虑将自己的投资阶段提前,更多的关注临床早期甚至临床前的药物。
在业界还在不断争论该如何制造自己的First in Class的时候,索元已在用其全球领先的Biomarker平台另辟蹊径,组建了一个针对多个重大临床未满足需求的,面向全球的First in Class创新药管线。未来将会有多个重磅药物出现在索元生物,让我们自己的创新药从跟跑冲入领跑。随着更多的First in Class项目在国内的展开,未来一定也会出现Billion级的收购或合作案例。
一个全新的模式难免受到质疑。“索元最初融天使轮的时候,很多人质疑我们能否从大药厂买到管线。买到了管线之后,又会质疑我们能否找到Biomarker。现在Biomarker找到了之后,我们还在继续按照既定的步伐前行。”索元生物的团队在面对这些质疑的时候显得无比从容。因为他们知道,等到他们最终爬到顶峰的时候,所有的质疑自然都会烟消云散。

如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。