
# 热门搜索 #
君联医疗新药速递 2020年第2期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
本周新药数据共7个,其中4个肿瘤,1个肌肉骨骼,2个血液疾病
❖FDA发布了2019年度新药审评报告,在2019年批准的新药共计48款,在近20年来仅次于2018年的59款,排在历史第二位。其中有几个数字引人瞩目,21款(44%)新药为治疗罕见病的孤儿药(超过肿瘤,跻身第一),20款(42%)为first-in-class新药,29款创新药(60%)至少获得FDA四大资格认定中的一种。在FIC的新药中,有2款药物是被着重highlight,1个是杨森的erdafitinib,属于口服泛FGFR抑制剂,也是FDA批准的首款针对转移性膀胱癌的靶向疗法;1个是Sage Therapeutics的Zulress,属于FDA批准的首个针对产后抑郁的新药。
❖ Blueprint Medicines宣布高选的RET抑制剂pralsetinib(BLU-667)在治疗RET融合的NSCLC的1/2期实验中获得积极结果,并准备滚动提交NDA申请。RET激活型融合和突变是许多癌症类型的关键疾病驱动因素,包括NSCLC(1%-2%比例为RET驱动)和MTC(甲状腺髓状癌,90%晚期由RET驱动),但目前还没有专门针对该突变的疗法。仑伐替尼和阿法替尼等dirty TKI虽然也能hit RET靶点,但仍被认为不够精准,且可能有脱靶毒性。所以pralsetinib(BLU-667)若顺利上市,将成为RET抑制剂领域的first in class,基石药业拥有BLU-667大中华区的独家开发和商业授权,目前在国内已经开展1期临床。
FDA批准Blueprint Medicines开发的Ayvakit上市,用于治疗GIST成人患者
FDA批准Blueprint Medicines开发的Ayvakit(avapritinib)上市,用于治疗无法切除或转移性胃肠道间质瘤(GIST)成人患者
大约6%的新确诊GIST患者携带PDGFA外显子18突变。Ayvakit(avapritinib)是一款强力的高特异性KIT和PDGFRA突变激酶抑制剂
在名为NAVIGATOR的1期临床试验的疗效结果中,携带PDGFRA外显子18突变的43名GIST患者接受了治疗
Ayvakit达到84%的总缓解率(95 CI: 69%,93%),7%的患者达到完全缓解,患者的中位缓解持续时间(DOR)尚未达到
ADC Therapeutics其ADC药物在治疗复发/难治性DLBCL患者的2期临床试验中达到主要终点
ADC Therapeutics宣布,其ADC药物loncastuximab tesirine(ADCT-402),在治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)患者的关键性2期临床试验中,达到试验主要终点
Loncastuximab tesirine是一种靶向CD19抗原的ADC
145名R/R DLBCL患者参与该项多中心,开放标签的2期临床试验。该试验主要评估loncastuximab tesirine作为单药疗法,治疗R/R DLBCL患者的疗效与安全性
loncastuximab tesirine的治疗使患者的ORR达到45.5%,其中20%的患者达到CR,达到该试验的主要研究终点
loncastuximab tesirine结构图
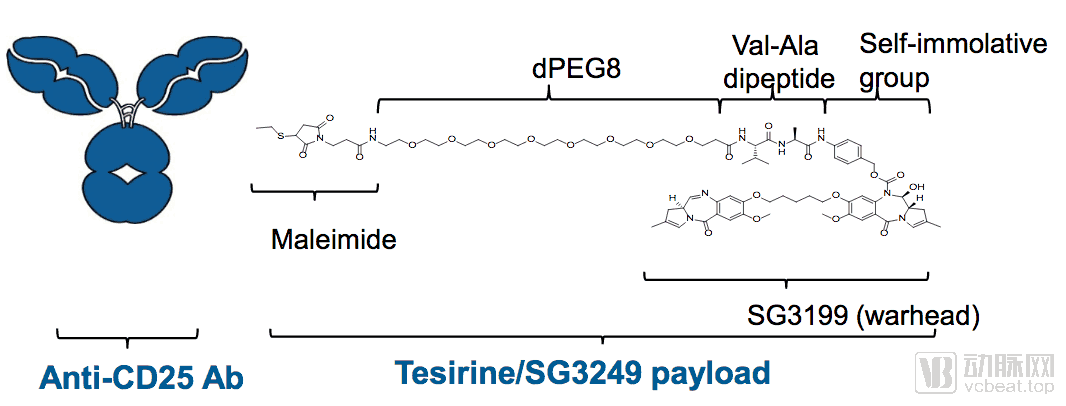
数据来源:ADC therapeutic
再生元宣布REGN2477在治疗进行性肌肉骨化症患者的2期试验中,达到主要终点
再生元宣布,其在研药物garetosmab(REGN2477),在治疗进行性肌肉骨化症患者的2期试验中,与安慰剂组相比,达到主要终点
garetosmab,能够与ACVR1基因编码的蛋白的下游靶点相结合,防止骨骼的异常生长
共有44名FOP成人患者参与了该项名为LUMINA-1的随机,双盲,含安慰剂对照组的2期临床研究
治疗28周后,与安慰剂相比,garetosmab的治疗使患者新病变的形成减少了近90%,使患者的总病变数量降低了25%
Blueprint宣布其RET抑制剂在治疗RET阳性NSCLC患者的1/2期临床研究中获得积极的顶线结果
Blueprint Medicines宣布其高选择性RET抑制剂pralsetinib(BLU-667),在治疗RET融合阳性非小细胞肺癌(NSCLC)患者的1/2期临床研究ARROW中,获得积极的顶线结果
pralsetinib针对最常见RET基因融合、激活突变和耐药突变始终表现出亚纳摩尔水平的效力。而且该药对RET的选择性与已批准的多激酶抑制剂相比有显著提高
1/2期实验,有2个亚组群。1个是80名先前接受过铂类化疗的RET融合阳性NSCLC患者亚组,1个是含有26名初治患者的亚组
在经治亚组中,pralsetinib的治疗使患者的ORR达到61%,并且使95%的患者肿瘤缩小,其中包括14% CR。在初治亚组,pralsetinib的治疗使患者的ORR达到73%,其中12% CR
FDA批准默沙东的Keytruda,用于治疗特定高风险非肌肉浸润性膀胱癌(NMIBC)患者
美国FDA宣布,批准默沙东(MSD)公司开发的重磅PD-1抑制剂Keytruda,治疗特定高风险非肌肉浸润性膀胱癌(NMIBC)患者
Keytruda是默沙东公司开发的重磅PD-1抑制剂
名为KEYNOTE-057的多中心单臂临床试验的结果。它包含148名高风险NMIBC患者,其中96名携带对BCG没有响应的原位癌
在96名对BCG无响应的高危患者中,Keytruda达到41%的完全缓解率(95% CI:31,51),达到完全缓解的患者中,中位缓解持续时间为16.2个月。46%的患者完全缓解时间超过12个月
Apellis宣布其在研C3补体抑制剂在治疗阵发性PNH成人患者的3期研究达到主要研究终点
Apellis宣布其在研C3补体抑制剂pegcetacoplan在治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者的3期研究PEGASUS中,达到试验的主要研究终点
pegcetacoplan是一种C3补体抑制剂,旨在调节许多疾病中过度的补体激活。Pegcetacoplan是与聚乙二醇聚合物偶联的合成环状肽,可以特异性结合C3和C3b
在3期临床研究,共有80名PNH成人患者参与其中。这些患者先接受为期四周的eculizumab和pegcetacoplan的治疗,而后在随机分别接受eculizumab或pegcetacoplan的治疗
治疗16周后,接受pegcetacoplan治疗患者的平均血红蛋白水平较活性对照组中患者改善了3.8g/dL
BMS与Acceleron宣布用于MDS患者的红细胞成熟剂Reblozyl在治疗贫血的关键3期实验中疗效显著
BMS与Acceleron近日宣布,用于骨髓增生异常综合症(MDS)患者的红细胞成熟剂Reblozyl(luspatercept-aamt) ,在治疗贫血的关键性3期实验,疗效显著
Reblozyl是一种红细胞成熟剂,用于需要定期输注红细胞的β地中海贫血成人患者,治疗贫血
MEDALIST是一项随机、双盲、安慰剂对照、多中心III期研究,在229例极低至中危MDS患者中开展,评估了luspatercept与安慰剂治疗贫血的疗效和安全性
与安慰剂组相比,luspatercept治疗组在研究的前24周(第1-24周)脱离红细胞输注(RBC-TI)≥8周的患者比例具有统计学意义的显著提高(38% vs 18%,p<0.001)
MEDALIST研究结果
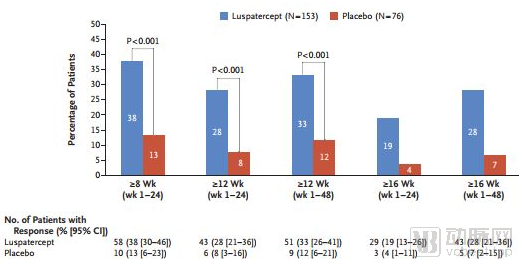
数据来源:NEJM
❖ 影响因子223.679的A Cancer Journal for Clinicians 发表了最新美国癌症统计报告,该报告根据截至2016年的癌症发病率和截至2017年的死亡率最新数据对癌症发生情况进行了全面概述,并指出美国癌症死亡率在2017年出现了有史以来最大幅度下降。其中1991–2017年间,美国癌症死亡率持续下降,总体降低29%,意味着癌症死亡数减少了290万例
❖FDA发布了2019年度新药审评报告,2019年批准的新药共计48款,在近20年来仅次于2018年的59款,排在历史第二位,其中21款(44%)新药为治疗罕见病的孤儿药,20款(42%)为first-in-class新药;29款创新药(60%)至少获得FDA四大资格认定中的一种,其中35%获得快速通道资格,27%获得突破性疗法认定,58%获得优先审评资格,19%获得加速批准
❖默沙东宣布与大鹏药品工业株式会社及大冢制药株式会社达成肿瘤小分子抑制剂的全球独家合作开发和许可协议。默沙东从大鹏和大冢获得小分子抑制剂候选药物的全球独家权利,为此向后两者支付5000万美元首付款,未来各种里程碑付款合计25亿美元。据悉,默沙东下重注的主要原因之一是大鹏现有的KRAS产品线
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。