
# 热门搜索 #
君联医疗全球新药资讯速递 · 第24期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
本周新药数据共9个,其中肿瘤6个,炎症2个,代谢1个。
❖ Amgen 的双特异性抗体Blincyto在首次复发的ALL的3期实验中由于疗效优异,提前终止了患者注册。Blincyto在美国2014年上市,可以同时结合CD3和CD19,当时被视为是革命性的疗法,但受困于半衰期太短,虽然近5年不断有新的成果出来,一直没有成为重磅炸弹,2018年的销售金额约为2.3亿美元。近3年国内的双特异性抗体赛道也是风起云涌,但尚没有成功的中期数据报道,抗体工艺的复杂程度和半衰期的控制可能是主要制约因素。
❖ 在溃疡性结肠炎的全球首个头对头3期研究中,武田Entyvio完胜Humira。IBD领域一直缺乏有效的治疗方案,类克和Humira虽然疗效尚可,但仍有接近40%以上的患者没有应答,这仍然是一个存在巨大未被满足需求的领域。除了Entyvio外,艾伯维和吉列德的JAK1也已经在3期尾声,预计会在2019年底前公布最终数据。虽然JAK1不是直接与Humira进行头对头实验(可能是忌惮于Humira的良好效果),但若获批,还是能给IBD患者提供一个更便利的口服治疗选择。
罗氏抗PD-L1单克隆抗体Telcentriq一线单药治疗NSCLC,
提高PD-L1高表达患者总生存期
罗氏开发的Tecentriq抗PD-L1单克隆抗体,已获得批准与化疗和Avastin联用一线治疗非鳞状NSCLC患者。在ESMO 2019上,罗氏公布了Tecentriq作为单药疗法,一线治疗NSCLC患者的临床结果。
Tecentriq是抗PD-L1单克隆抗体。
随机,开放标签的3期研究,共有572名患者参与。目的是评估Tecentriq与顺铂或卡铂和培美曲塞或吉西他滨(化疗)相比,一线治疗晚期NSCLC患者的疗效和安全性。这些患者不携带ALK或EGFR基因突变。
试验结果表明,Tecentriq在中期分析中达到了试验的主要终点,与化疗相比,将PD-L1高表达患者的总生存期(OS)提高7.1个月。
The Medicines Company降胆固醇RNAi疗法Inclisiran再获佳绩,
达到两项3期临床试验终点
The Medicines Company宣布其降低胆固醇的RNAi疗法Inclisiran,在治疗杂合子家族性高胆固醇血症(HeFH)和动脉粥样硬化性心血管病(ASCVD)的3期试验,达到所有主要和次要终点。
Inclisiran是用GalNAc递送系统设计的靶向PCSK9的RNAi疗法,是第一款可以降低LDL-C的RNAi疗法。
随机,双盲,含安慰剂对照组的3期临床试验,分别由482名LDL-C高水平的HeFH患者(ORION-9试验)和1561名LDL-C高水平的ASCVD患者(ORION-10试验)参与。
在ORION-9试验中,患者的LDL-C水平较基线时显著降低。在ORION-10试验中观察到的结果证明了Inclisiran的出色疗效,耐受性和安全性。
杨森Erleada与雄激素剥夺疗法联用,
降低非转移性去势抵抗性前列腺癌患者死亡风险
杨森公布了Erleada与雄激素剥夺疗法(ADT)联用,治疗非转移性去势抵抗性前列腺癌(nmCRPC)的疗法中,在提高患者生存率方面的最新结果。
Erleada(Apalutamide)是一种新一代雄激素受体抑制剂。
对名为SPARTAN的3期临床试验长期结果的中期进行分析。
Erleada与ADT联用,与ADT相比,将nmCRPC患者的死亡风险降低25%。在中位随访时间达到41个月时,Erleada组的4年总生存率(OS)为72.1%,而对照组为64.7%。
安进双特异性抗体疗效显著优于化疗,
3期试验提前终止
安进(Amgen)公司宣布,该公司开发的双特异性抗体Blincyto(Blinatumomab),在治疗首次复发的高危B细胞急性淋巴细胞白血病(ALL)儿科患者的两项3期试验中,由于疗效显著优于化疗对照组,患者注册提前终止。
Blincyto是首款获批的双特异性T细胞接合器(BiTE),它的一端与B细胞表面表达的CD19抗原相结合,另一端与T细胞表面的CD3受体相结合。
在名为20120215的开放标签,随机,全球性3期试验中,高危首次复发B细胞ALL儿童患者接受了Blincyto或者标准巩固化疗的治疗。试验的主要终点为无事件生存期(event-free survival)。
Blincyto达到了试验的主要终点。基于独立数据监督委员会(DMC)的建议,安进提前终止了这一试验的患者注册,后续随访仍然将按照试验流程进行。
Blincyto作用机制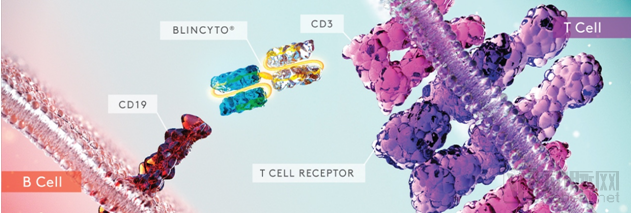
数据来源:Amgen
Tecentriq与Avastin联用,
提高肝细胞癌患者缓解率
在ESMO 2019上,罗氏公布了Avastin与Tecentriq构成的组合疗法治疗肝细胞癌的1b期临床试验结果。该疗法已经在2018年7月,获得美国FDA授予的突破性疗法认定,治疗晚期或转移性肝细胞癌。
Avastin是针对血管内皮生长因子(VEGF)的抗体,通过直接结合VEGF干扰肿瘤的血液供应,抑制肿瘤生长和扩散。
名为GO30140的1b期临床研究分为非随机试验和随机试验两个部分。
非随机患者队列的结果表明,在中位随访时间为12.4个月时,接受Tecentriq与Avastin联合治疗的患者达到36%的客观缓解率(ORR),其中达到完全缓解(CR)的患者比例为12%。随机试验部分的结果表明,与Tecentriq单药治疗相比,Tecentriq和Avastin联用使疾病恶化或死亡风险降低了45%。
Intercept Pharmaceuticals宣布向FDA提交了奥贝胆酸治疗非酒精性脂肪性肝炎引起的肝脏纤维化的NDA
Intercept Pharmaceuticals宣布向FDA提交了奥贝胆酸治疗非酒精性脂肪性肝炎(NASH)引起的肝脏纤维化的上市申请(NDA)。
奥贝胆酸是当前唯一一个在治疗NASH的关键III期研究中到达主要终点的药物,也是唯一一个获得FDA突破性药物资格认定的NASH新药。
基于关键的随机、双盲、安慰剂对照、III期REGENERATE研究的数据,招募750伴有肝脏纤维化的NASH患者,给药72周(18个月)。
期中分析,OCA 25mg每日1次治疗组第18个月,肝纤维化程度至少改善1级且NASH没有恶化的患者比例显著高于安慰剂组(23.1% vs 11.9%,p=0.0002)。10mg和25mg治疗组第18个月,NASH组织病理学改善(脂肪蓄积减少)且纤维化程度没有恶化的患者比例较安慰剂组均有提高,但是在统计上没有显著差异。
UC领域首个头对头生物制剂研究,
武田Entyvio完胜Humira
武田制药宣布Entyvio(vedolizumab)治疗溃疡性结肠炎(UC)的III期临床VARSITY(NCT02497469)的进一步结果已发表于《新英格兰医学杂志》。
Entyvio是一种肠道选择性生物制剂,其活性药物成分为vedolizumab,这是一种人源化单克隆抗体,可特异性拮抗α4β7整合素。
VARSITY是一项随机、双盲、双模拟、多中心、阳性药物对照、IIIb期研究,旨在评估Entyvio静脉注射(IV)与Humira皮下注射(SC)用于中度至重度活动性UC患者治疗一年(52周)的疗效和安全性。
研究达到了主要终点,与Humira组相比,Entyvio组在第52周临床缓解率方面表现出优越性(31.3% vs 22.5%,p=0.006)。探索性分析显示,在第52周,与Humira相比,Entyvio在抗TNFα初治患者亚组(34.2% vs 24.3%)和抗TNFα经治患者亚组(20.3% vs 16.0%)取得了更高的临床缓解率。
VARSITY研究-UC临床缓解结果对比
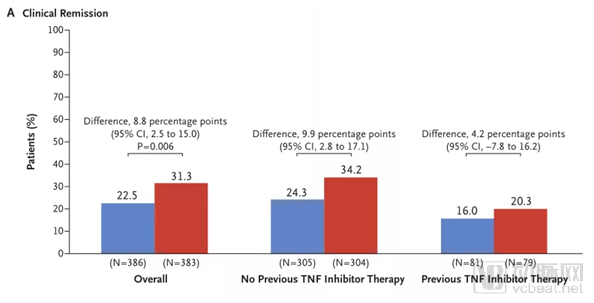
备注:红色为vedolizumab,蓝色为adalimumab
数据来源:新英格兰医学杂志
再鼎医药Optune用于治疗胶质母细胞瘤已获得CMDE受理
再鼎医药是在2018年9月宣布从Novocure 公司获得Optune在中国(含香港、澳门、台湾)地区的独家商业许可,负责Optune在以上地区的开发和上市。
Optune的原理是肿瘤电场治疗(Tumor Treating Fields, TTFields),其通过低强度、中频(200 kHz)的交流电场在肿瘤内部形成低强度的交流电场,对携带电荷的细胞施加物理力,通过干扰肿瘤细胞的有丝分裂诱发肿瘤细胞凋亡,并抑制肿瘤生长。
在新确诊的胶质母细胞瘤患者中进行的国际III期研究,与单独使用替莫唑胺进行对比。
相比单独使用替莫唑胺,Optune+替莫唑胺可以使患者的中位总生存期由16个月延长至20.9个月,5年生存率提高2倍以上(5% vs 13%),每天穿戴Optune超过22小时的高依从性患者,5年生存率可提高到29.3%。
拜耳不区分肿瘤类型的治疗药物 Larotrectinib 获欧盟批准
拜耳公司近日宣布,欧盟已授予肿瘤精准治疗药物Larotrectinib的上市许可。该药物适用于治疗局部晚期,远端转移,无法手术切除或手术疗效欠佳的,且无满意替代治疗方案的神经营养性受体酪氨酸激酶(NTRK)基因融合的成人和儿童实体瘤患者。
Larotrectinib是首个口服TRK抑制剂。
基于102例患者临床试验数据的汇总分析(93例患者来自主要分析人群,另外9例为原发性CNS肿瘤患者),包括成人患者的I期临床试验,成人和青少年患者的II期NAVIGATE试验以及儿科I/II期SCOUT试验。
主要分析人群(n=93)中的结果显示,客观缓解率(ORR)为72%(95% CI: 62, 81),包括16%的完全缓解(CR)和55%的部分缓解(PR)。
❖ 2019MSS结直肠癌免疫治疗取得突破性进展。突破一:Nivo+瑞戈非尼≥3线治疗晚期MSS型结直肠癌和胃癌患者,有效率36%。突破二:PD1单抗+CTLA4单抗+放疗≥3线治疗MSS型患者,有效率为15%。突破三:PDL1单抗durvalumab+CTLA4单抗tremelimumab≥3线治疗晚期结直肠癌患者,TMB高的人群获益更为明显。突破四:术前放化疗序贯PD1治疗MSS型结直肠癌患者,病理性pCR率可以达到30%。
❖ 阿斯利康抗凝血剂Brilinta IV期独立研究TWILIGHT的数据显示,在已接受经皮冠状动脉介入治疗并完成3个月双重抗血小板治疗的高危患者中,Brilinta单药方案与Brilinta+低剂量阿司匹林方案相比继续治疗12个月后降低了临床相关出血风险,同时没有增加主要不良心血管事件复合风险。
❖ Jazz Pharmaceuticals在研药物JZP-258,在治疗成年发作性睡病患者的白日过度嗜睡3期试验中,达到了主要终点和关键性次要终点。与安慰剂组相比,接受JZP-258治疗的患者每周猝倒发作次数,以及Epworth嗜睡量表得分的变化达到统计学意义的显著改善。
❖ vTv Therapeutics治疗1型糖尿病的辅助药物——肝选择性葡萄糖激酶激动剂TTP399,在名为Simplici-T1的2期临床第1部分的新添试验数据显示,TTP399改善患者血糖在目标范围内的时间,减少了高血糖的时间,降低了低血糖事件和胰岛素注射剂量。
❖ Zealand Pharma宣布Dasiglucagon治疗糖尿病严重低血糖的儿科III期临床研究的积极结果,结果显示,Dasiglucagon治疗组血糖恢复时间的中位数为10分钟,优于安慰剂组。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。