
2019年4月29日-2019年5月5日,本周新药数据共15个,其中肿瘤6个,血液病和代谢疾病各2个,肝部、艾滋、眼科、神经和热带疾病各1个。
●蓝鸟公布了其BCMA CAR-T疗法治疗复发难治性多发性骨髓瘤的1期数据。BCMA靶点是CD19之外另一个大热的CART靶点,而且由于其主要表达在成熟B细胞表面,被认为对多发性骨髓瘤具有高度特异性。目前在BCMA靶点的开发竞赛中,冲在赛道最前方的是新基和Bluebird的bb2121,紧跟其后的是南京传奇的LCAR-B38M。
●赛诺菲的登革热疫苗Dengvaxia经历20年的风风雨雨终获FDA批准,成为FDA批准的首个登革热疫苗。不过该款疫苗一旦注射给未得病的患者将会带来很高的重症和死亡风险,所以该药物上市过程中屡次遭遇危机,即使获批了但是仍有争议。FDA此前授予了Dengvaxia优先审评资格,并授予赛诺菲一张热带疾病优先审评券。
●抗体偶联药物风头正劲。本周阿斯利康和第一三共联合开发的新型抗体偶联药物DS-8201取得93.7%的乳腺癌疾病控制率;基因泰克新型抗体偶联药物Kadcyla较赫赛汀降低患者死亡风险50%,获批治疗早期乳腺癌;同时本周国内诞生了有史以来最大的License-in交易,也是针对抗体偶联药物,Everest公司以超过8.35亿美元的总潜在价格(6500万美金的首付款,后续royalty为14-20%)获得了抗体偶联药品sacituzumab govitecan,该药物将用于实体瘤的治疗。
地西他滨联合恒瑞PD-1单抗
治疗复发难治性霍奇金淋巴瘤疗效惊人
解放军总医院韩卫东教授利用卡瑞利珠单抗联合地西他滨治疗复发难治性霍奇金淋巴瘤的二期临床试验成果在《J Clin Oncol》(影响因子26.303)发表,数据显示该联合疗法效果惊人。
卡瑞丽珠单抗是恒瑞自主研发的PD-1单抗,本次临床试验由恒瑞免费提供,地西他滨由正大天晴提供。
本次临床实验是一项单中心、开放性、双臂的2期临床研究。Cohort 1为PD1 naïve的患者,使用卡瑞利珠单抗或卡瑞利珠单抗+吉西他滨治疗;cohort 2为PD1治疗后复发,然后使用卡瑞利珠单抗+吉西他滨治疗。
在cohort 1中,单药组和联合组的CR分别为32%和71%;在cohort 2,联合用药的ORR为52%,CR为28%。
蓝鸟公布其BCMA - CAR-T疗法
治疗复发难治的多发性骨髓瘤临床数据
近日,蓝鸟与新基共同开发的BB21疗法治疗复发难治性的多发性骨髓瘤的1期临床数据在新英格兰医学杂志NEJM上发表。
BB2121是一种靶向B细胞成熟抗原(BCMA)的CAR-T疗法。
本试验公布了33名患者的数据,每位患者至少接受过三次治疗,以50×〖10〗^6, 150×〖10〗^6, 450×〖10〗^6, 800×〖10〗^6的CAR阳性T细胞剂量进行剂量爬坡试验。
本次试验中共有25名,即76%的患者有细胞因子释放综合征,其中23名患者为1/2级。14名,即42%的患者发生神经系统毒性反应。客观缓解率为85%,完全缓解率为45%。患者中位无进展生存期为11.8个月,虽然这有点低于投资者此前15个月的预期,但考虑到这些患者平均都接受过7种疗法,而且每人至少接受过1次干细胞移植,所以该数据也算比较惊艳。
BB2121的输入应答效果
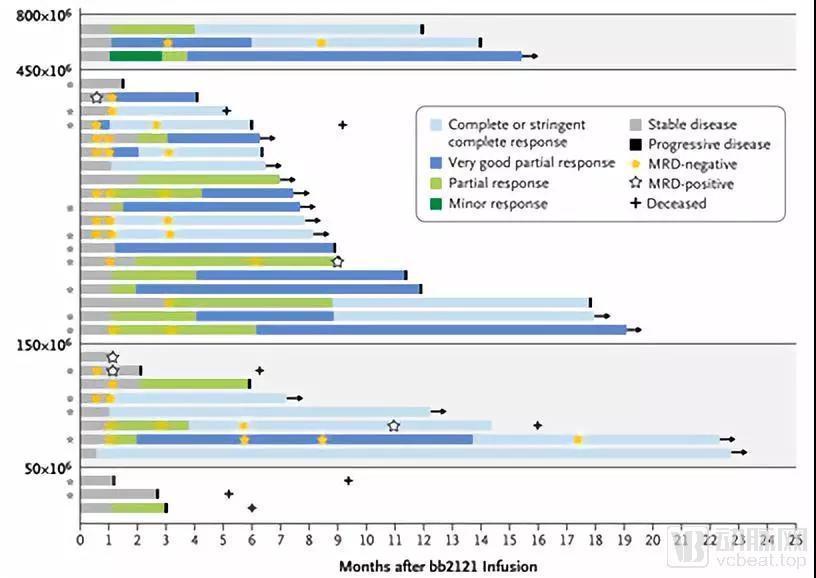
数据来源: New England Journal of Medicine
第一三共&阿斯利康新型抗体偶联药物
取得93.7%的乳腺癌疾病控制率
第一三共和阿斯利康宣布双方共同开发的抗体偶联药物DS-8201在治疗HER2+转移性乳腺癌和胃癌的1期临床中取得了积极的疗效。
DS-8201是第一三共开发的靶向HER2的抗体偶联药物,通过四肽接头连接了靶向HER2受体的全人源化单克隆抗体trastuzumab和一种新型拓扑异构酶1抑制剂。
115名Her2+转移性乳腺癌患者接受了DS-8201的治疗。
实验结果显示,客观缓解率达到59.5%,疾病控制率达到93.7%,中位无进展生存期为22.1个月。
基因泰克新型抗体偶联药物Kadcyla
获批治疗早期乳腺癌
基因泰克宣布FDA批准其新型抗体偶联药物Kadcyla(ado-trastuzumab emtansine)扩大适应症,作为术后辅助疗法治疗Her2阳性的经治疗后有残余病灶的早期乳腺癌患者。
Kadcyla是一款新型抗体偶联药物,一端靶向Her2抗体trastuzumab,一端连接化疗药物DM1。
一项名为KATHERINE的3期临床试验。
试验结果显示,使用Kadcyla的患者相较使用赫赛汀的患者群体,乳腺癌复发或死亡风险显著降低了50%。
默克的PDL1-TGF-β融合蛋白
显著改善HPV相关癌症的预后
美国国家癌症研究所的一项临床研究结果表明,默克公司和GSK共同研发的bintrafusp alfa双特异性疗法能够有效缩小人乳头瘤病毒(HPV)阳性的肿瘤大小,大幅延长患者总生存期。
Bintrafusp alfa是一种能够结合PD-L1和TGF-β两个靶点的融合蛋白。
该1期临床试验共计纳入43例晚期癌症患者,其中36例为HPV阳性。
实验结果显示,35%的患者肿瘤缩小,该比例在HPV阳性的肿瘤患者中为39%。43例患者的中位OS为16.2个月, 对比先前的试验中, 传统PD-1或PD-L1的免疫检查点抑制剂治疗HPV相关癌症的存活率只有9至11个月。
Bintrafusp alfa结构
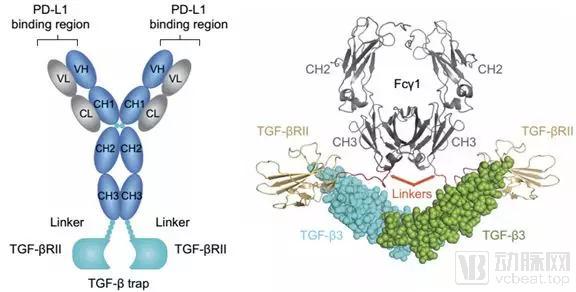
数据来源:Science Translational Medicine
降低肿瘤转移和死亡风险近60%
拜耳前列腺新药获FDA授予优先评审资格
FDA近日接受了拜耳公司雄激素受体拮抗剂darolutamide的新药申请并授予了优先审批资格,该药物用于治疗非转移性去势抵抗性前列腺癌。
Darolutamide是一种非甾体雄激素受体拮抗剂。
本次优先审批资格授予基于名为ARAMIS的3期随机双盲、安慰剂对照临床试验,共计1509名患者接受了darolutamide或安慰剂治疗。
接受darolutamide质量的患者中位无转移生存期为40.4个月,安慰剂组为18.4个月。同时该药物副作用非常少,与安慰剂安全性相当。
Agios宣布旗下IDH1抑制剂Tibsovo
获批一线治疗急性骨髓性白血病
美国Agios Pharmaceuticals公司旗下IDH1抑制剂Tibsovo获FDA批准拓展适应症范围,用于一线治疗携带易感异柠檬酸脱氢酶-1(IDH1)基因突变的急性骨髓性白血病(AML)患者。对于由于年龄较大或其他合并症不能接受强力化疗的该类AML患者,Tibsovo是第一款也是唯一一款获批疗法。
Tibsovo是一款first-in-class口服IDH1抑制剂。
这一批准基于Tibsovo在一项28名病人的开放标签、单臂、多中心的临床试验结果。
试验结果表明,接受治疗的患者中有28.6%达到完全缓解,14.3%达到完全缓解加部分血液学改善,这些达到完全缓解的患者中有58.3%在治疗后1年仍处于缓解期。
Orchard Therapeutics自体造血干细胞基因疗法
成功减少输血依赖性β地中海贫血患者输血需求
Orchard Therapeutics在第22届美国基因与细胞治疗学会(ASGCT)年会上公布了基因疗法OTL-300治疗输血依赖性β地中海贫血(TDBT)的临床概念验证数据,数据证明该疗法能有效降低患者的输血需求。
OTL-300基因疗法是一款利用慢病毒的体外自体干细胞基因疗法。
本次会议报告了OTL-300的6例儿童患者和3例成人患者的疗效和安全数据。
全部9名患者在16个月到43个月的随访期内都达到了生存的安全终点,同时有8例达到了了12个月输血减少的主要疗效终点。
赛诺菲开发的首款登革热疫苗获批上市
赛诺菲开发的首款登革热疫苗Dengvaxia获得FDA批准上市,可以用于在9到16岁人群中预防由所有血清型(1、2、3和4型)登革热病毒疾病,但该款疫苗仅能注射给有实验室确认的登革热感染史的病人。
Dengvaxia是赛诺菲开发的减毒活性疫苗登革热疫苗,接种该疫苗包括三次注射,每次注射之间需要间隔6个月。
本次批准基于三个随机、安慰剂对照、在登革热流行地区开展的临床试验,总计接种人数接近35000名。
试验数据显示,该款疫苗在9-16岁人群中有76%的有效性。
FDA批准艾伯维首款治疗
所有基因型的丙肝病毒儿童疗法
艾伯维公司的Mavyret(glecaprevir和pibrentasvir)获FDA批准扩展其适用范围,用于在12-17岁儿童患者中治疗所有6种基因型的丙肝病毒(HCV)感染。
Mavyret由抑制HCV NS3/4A蛋白酶活性的glecaprevir和抑制HCV NS5A活性的Pibrentasvir组成。
本次批准基于47名儿童患者的临床试验。
接受治疗的患者100%在治疗结束后12周的血液检测中检测不到病毒,即患者被治愈。
ViiH提交首个长效注射型双药HIV疗法新药申请
ViiH Healthcare公司宣布向FDA递交了杨森公司的rilpivirine和ViiV公司的cabotegravir构成的双药HIV组合疗法的新药申请。该药物每个月只需注射一次,若能获批将成为首款长效注射型双药HIV疗法。
该药物是由杨森公司的rilpivirine和ViiV公司的cabotegravir构成。
该新药申请基于名为ATLAS和FLAIR的关键性3期临床试验结果,两项临床试验总计包含超过1100名患者。
每月一次的新型疗法与现有的标准疗法在抑制病毒方面效果相同。
欧盟首批SGLT1/2双重抑制剂治疗1型糖尿病
欧盟宣布批准赛诺菲和Lexicon Pharmaceuticals联合开发的Zynquista(sotagliflozin)上市,用于辅助控制1型糖尿病患者的血糖。这是Zynquista在世界范围内首次获批治疗1型糖尿病患者。
Zynquista是SGLT1/SGLT2的口服抑制剂。
本次批准基于名为inTandem的临床试验项目,包括3项3期临床试验,共计3000名1型糖尿病患者接受治疗。
临床研究显示,Zynquista在24周时,能够显著降低患者的糖化血红蛋白、体重及收缩压水平。较胰岛素单药疗法,Zynquista辅助疗法的患者血糖水平区间和患者报告结果数据更佳。
阿斯利康2型糖尿病三连疗法
Qternmet获FDA批准上市
阿斯利康宣布公司开发的Qternmet XR缓释片获FDA批准上市,用以改善2型糖尿病患者的血糖水平。
Qternmet XR是达格列净,沙格列汀和二甲双胍组成的每日一次口服三联复方疗法。
本次批准基于两项3期临床试验。
对于接受二甲双胍背景治疗的患者人群,加入达格列净和沙格列汀组合治疗能够显著降低患者糖化血红蛋白水平,并且提高达到糖化血红蛋白治疗目标水平的患者人数。
ReNeuron公司开发祖细胞疗法在
视网膜色素变性1/2a期临床实验中
取得积极初步结果
ReNeuron公司宣布旗下开发的人类视网膜祖细胞疗法在视网膜色素变性1/2a期临床实验中取得积极初步结果。
该疗法通过在患者视网膜下注射人类视网膜祖细胞,帮助分化出新的感光细胞,从而恢复患者视力。
3名患者在一项开放标签的临床实验中接受了该疗法的治疗。
患者的视力与基线相比得到了显著和持续的改善。
Biogen公司反义RNA药物ALS药物BIIB067
在早期实验中结果积极
Biogen从Ionis Pharmaceuticals获得的tofersen(BIIB067)在1期实验中结果积极,试验结果表明该药物可以减缓具有突变SOD1基因的肌萎缩侧索硬化症(ALS)患者的疾病进展。
Tofersen是一种反义寡核苷酸,旨在减少有毒蛋白质的产生。
1期临床实验中, 50名SOD1突变的ALS患者在3个月时间内通过腰椎穿刺接受20mg,40mg,60mg或100mg的tofersen或安慰剂。
与接受安慰剂的12人相比,最高剂量tofersen组的10人的脊髓液中SOD1蛋白减少了37%。

●迄今为止国内最大的licence-in交易诞生,由康桥资本和美国生物技术公司Immunomedics投资的Everest以总计超过8.35亿美元的总潜在价格获得了明星抗体偶联药物Sacituzumab Govitecan(IMMU-132)日本以外亚洲市场开发和商业化治疗所有癌症的权益。Sacituzumab是一款first-in-class的抗体偶联药物,由SN-38和抗Trop-2单克隆抗体部分组成,靶向众多实体瘤过表达的Trop-2受体,同时可将SN-38药物递送至肿瘤细胞进行治疗。
●Applied DNA Sciences的子公司LineaRx公司宣布,该公司利用Solupore平台提高了无病毒或质粒的条件下向人类T细胞递送线性DNA构建体的表达水平和存活率。通过与Avectas的合作,LineaRx将细胞存活率提高了四倍以上,其模型扩增子的线性基因表达也提高了50%以上。
●Bellicum Pharmaceuticals成功改造了一种双开关CAR-T细胞,其开发的基于rimiducid的诱导型MyD88和CD40(iMC)信号元件,以及雷帕霉素诱导的基于caspase-9的安全开关(iRC9),能够在以药物依赖性方式促进CAR-T细胞扩增的同时延长扩增的持久性,还能提供安全开关以减轻毒性。
●Transgene公司近日宣布与阿斯利康达成独家授权协议,利用Transgene专有的新型病毒技术平台Invir.IO,共同开发5个溶瘤病毒候选疗法。Transgene公司的技术平台能够将外源的转基因导入溶瘤病毒中,让溶瘤病毒在裂解肿瘤细胞的同时,表达治疗性蛋白,进一步增强溶瘤病毒疗效。
●基石药业和瑞士Numab Therapeutics AG公司宣布双方就候选药物ND021的开发和商业化达成区域性独家授权协议。ND021是一种针对PD-L1,4-1BB和人血清蛋白的单价三特异性抗体片断分子。根据协议,基石药业将获得在大中华区及韩国、新加坡独家开发和商业化ND021的权益,同时基石药业将提供研发资金直至ND021完成初步的Ib期临床试验。
●阿斯利康公司与BenevolentAI宣布达成长期研发合作协议,两家公司将合作使用人工智能和机器学习技术,研发治疗慢性肾病和特发性肺纤维化的创新疗法。这是继近日吉利德科学与Insitro公司达成研发协议,利用机器学习开发NASH的创新靶点之后,又一家大型医药公司与AI药物研发生物科技公司展开合作。

































