
# 热门搜索 #
首款三阴性乳腺癌免疫疗法!FDA批准罗氏Tencentriq用于三阴性乳腺癌
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持动脉新医药(biobeat1)获悉,2019年3月8日,FDA(美国食品和药物管理局)批准罗氏旗下Genentech Inc.的PD-L1单抗Atezolizumab(TECENTRIQ®)与紫杉醇结合蛋白的疗法。对于无法切除的局部晚期或具转移性的三阴性乳腺癌(TNBC)患者,只要其肿瘤有明显的PD-L1表达,就可以按FDA规定用药。
同时FDA还批准VENTANA PD-L1(SP142)Assay作为Atezolizumab的伴随诊断设备,用于筛选可以应用本疗法的三阴性乳腺癌患者。
本次批准基于IMpassion130(NCT02425891)。这是一项多中心,国际范围,双盲,安慰剂对照的随机试验,其中包括了902例无法切除的局部晚期或具转移性的TNBC患者。这些患者均未曾接受过用于转移性疾病的化疗。患者被1∶1随机分组,按照28天的周期,在每个周期的第1天和第15天接受Atezolizumab(840 mg)或安慰剂静脉注射,并在第1天通过静脉注射给予紫杉醇蛋白(100mg/ m2)。
PD-L1阳性群体通过VENTANA PD-L1(SP142)测定法检测肿瘤标本筛选而出。筛选结果用于最终的PD-L1阳性群体判定。
在肿瘤表达PD-L1的患者中,接受atezolizumab单抗与紫杉醇结合蛋白免疫疗法的患者,其无进展生存期(PFS)中位数为7.4个月(6.6,9.2),对于接受紫杉醇蛋白安慰剂的患者为4.8个月(3.8,5.5)。无进展生存期风险比为0.60(95%置信区间[CI]:0.48,0.77; p <0.0001),有利于Atezolizumab加紫杉醇结合蛋白疗法。Atezolizumab单抗组的客观缓解率(ORR)为53%,而安慰剂组仅为33%。总生存数据粗略计算为死亡率43%。
Atezolizumab单抗与紫杉醇结合蛋白疗法的最常见不良反应(报告≥20%的患者)有脱发、外周神经病、疲劳、恶心、腹泻、贫血、便秘、咳嗽、头痛、中性粒细胞减少、呕吐和食欲下降。
这一适应症基于临床实验的无进展存活情况,在加速审批中获批。对于该适应症的进一步审批将取决于验证试验中对临床获益的验证和描述。
对于肿瘤表达PD-L1的TNBC患者,推荐的Atezolizumab剂量是840mg,在60分钟内静脉输注,然后注射100mg/m2紫杉醇结合蛋白。每28天一个周期,在第1天和第15天施用Atezolizumab,并且在第1、8和15天施用紫杉醇结合蛋白直至疾病进一步发展或发生不可接受的毒性症状。
Tencentriq(Atezolizumab)是罗氏旗下的Genentech公司生产的PD-L1单抗,本次批准的三阴性乳腺癌是Tencentriq获批的第三种适应症。2018年罗氏制药的年报显示,Tecentriq收入增长60%,销售收入7.89亿美元。
2016年10月18日,FDA批准了Atezolizumab用于治疗转移性非小细胞肺癌(NSCLC)患者,这是Tencentriq获批的第一种适应症。2018年12月6日,Atezolizumab与贝伐单抗、紫杉醇和卡铂的联合疗法又进一步获批为针对转移性非鳞状非小细胞肺癌的一线疗法。
2018年8月16日,FDA又批准Atezolizumab用于治疗局部晚期或转移性尿路上皮癌。
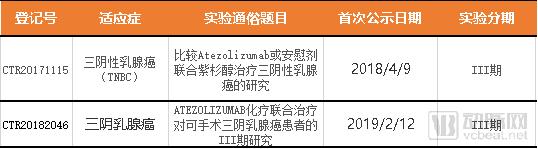
表:Atezolizumab在国内针对三阴性乳腺癌的临床研究
在2018年2月25日,罗氏制药已经为Tencentriq(Atezolizumab)向国家药品监督管理局递交了上市申请,具体适应症暂时未知。目前罗氏制药已经在国内为Atezolizumab开展了针对非小细胞肺癌、肌层浸润性尿路上皮癌、三阴性乳腺癌、肝细胞癌、肾细胞癌等多种适应症的19项临床研究,并且多项研究已经进入三期临床阶段。针对三阴性乳腺癌的临床研究有两项,都在Ⅲ期临床阶段。
三阴性乳腺癌是指癌组织免疫组织化学检查结果为雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2均为阴性的乳腺癌。这类乳腺癌占所有乳腺癌病理类型的10.0%~20.8%,具有特殊的生物学行为和临床病理特征,预后较其他类型差。
对于转移性三阴性乳腺癌目前的主要治疗方法仍是化疗,而该类型癌症在获得诊断后通常只有20个月的生存期。Atezolizumab是第一款获批用于三阴性乳腺癌的免疫治疗药物。
Tencentriq(Atezolizumab)的主要竞争对手是默沙东的Keytruda(Pembrolizumab)和BMS的Opdivo(Nivolumab)。根据默沙东和BMS的2018年年报,Keytruda在2018年销售额达到了惊人的71.71亿美元,而BMS的Opdivo(Nivolumab)则有67.35亿美元。
在美国,Keytruda基于三阴性乳腺癌的临床研究目前也已经进入到了Ⅲ期临床阶段,预计在2019年内完成。而Keytruda在国内的临床研究则还未涉及三阴性乳腺癌。Opdivo针对三阴性乳腺癌的临床研究则相对较慢,还停留在Ⅰ/Ⅱ期临床,国内同样也还未开展。
从目前的临床研究情况上看,Atezolizumab还会在未来一段时间内保持在三阴性乳腺癌上的领先优势。再加上去年下半年获批的另一适应症,Tencentriq在今年的销量很可能会继续高歌猛进。
参考资料
1. FDA approves atezolizumab for PD-L1 positive unresectable locally advanced or metastatic triple-negative breast cancer from https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm633065.html
2.FDA Action Alert: Regeneron, Celgene and Aerie from https://www.biospace.com/article/fda-action-alert-regeneron-celgene-and-aerie/

如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。