
# 热门搜索 #
创新医械特审通道是独木桥吗?从2016年最后一个获批医械谈起
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持文|火石创造 行肖
2017年,《医疗器械优先审批程序》正式开始实施,这条注册之路是否好走,或许尚不明了,但是关注一下2014年创新医疗器械特别审批程序开通以来国内的审批情况,或许可以对我们有所帮助。
近日,国家食品药品监督管理总局(CFDA)发布公告表示批准肺动脉带瓣管道这一心血管植入器械注册,这或许是2016年最后一个获得CFDA特别审批上市的创新医疗器械。

该产品是佰仁医疗除了“人工生物心脏瓣膜”、“瓣膜成形环”和“外科生物补片”之外的又一重磅产品,不但是国家 863 科技计划攻关重大课题,也是国家科技支撑计划“十二五”课题重大科技项目成果。
肺动脉带瓣管道属于Ⅲ类植入医疗器械,以健康黄牛颈静脉血管和牛心包为原材料,制成带有内置形似天然肺动脉瓣膜结构的产品,主要用于重建复杂先天性心脏病(以下简称:先心病)患儿右心室出口至主肺动脉末端及左右肺动脉的连接。
先天性心脏病已经连续十余年成为我国5岁内儿童死亡的首要原因,大约每7个5岁以下死亡儿童中就有一个死于先心病,尤其是复杂性先心病,其自然生存率之低、治疗难度之大,一直是心外科和儿科之殇。并且,生物材料带瓣管道在临床上可以说是一种刚需,患儿必须有这样的产品才能存活下去,但是以往并没有类似的产品可以使用,甚至只能从死囚身上获取,既不配套又不太符合人道主义。
因此,此次产品的获批,不仅填补了国内市场乃至世界市场的空白,更是为复杂性先心病儿童重获新生提供了强大的武器,对于整个产业和所有患儿家庭的意义是不可言喻的。
特别审批通道开通以来的申报情况
自从2014年2月7日《创新医疗器械特别审批程序(试行)》发布以来,CFDA对创新医疗器械设置的特别审批通道已经批准了许多创新医疗器械的上市,对医疗器械新技术的推广和应用以及医疗器械产业的发展起到了积极的推动作用。
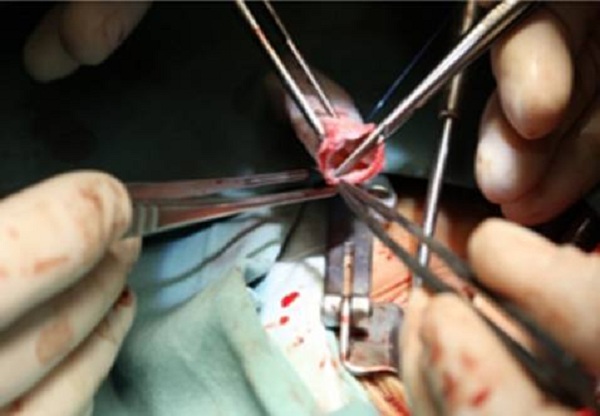
除了此次批准的肺动脉带瓣管道之外,2016年获得CFDA特别审批的还有创新人工晶状体、骨科手术导航定位系统等在同类产品中都为首例或者达到甚至超过国际同类水平的器械,详见下表。
2016年通过CFDA特别审批的创新医疗器械
数据来源:HSMAP
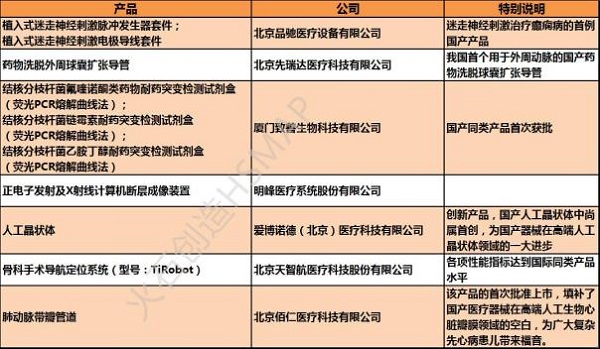
两年来,通过审查进入特审程序的产品逐年增加,随着“十三五”规划的推行和我国企业在医疗器械研发上的不断创新,这样的增长势头还将继续保持。
数据来源:CFDA
截至2016年11月22日,CFDA已经对2016年通过审查的45个创新医疗器械产品进行了公示,整个2016年进入特审程序的产品或将有望突破50个。
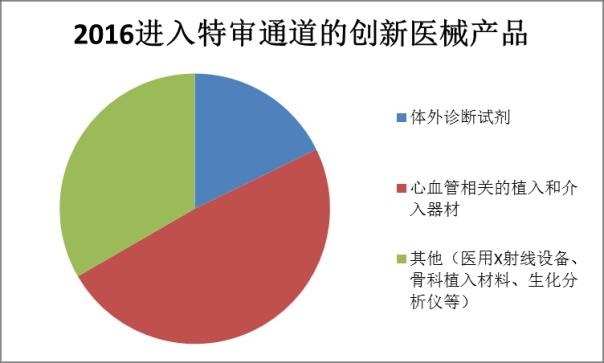
数据来源:CFDA
其中,心血管介入器械、心血管植入物等心血管相关的产品占到了一半左右,体外诊断试剂也大约占了17%,还有部分生化分析仪、监护系统等。
特审通道虽然诱人,但是也不太好走
对于创新医疗器械的特别审批,从申报到注册完毕的时间相比于以往的审批程序来说大大缩短,最短的甚至从公示到注册完毕只需要两个多月的时间。如此高效的审批效率,使得企业申报创新医疗器械的热情空前高涨。
但是相对来讲,能够最终注册成功的产品却屈指可数。根据2016年CFDA官方透露的数据显示,截至2016年6月底,CFDA共收到创新医疗器械特别审批申请379项,完成审查356个,确定68个产品进入创新医疗器械特别审批通道,通过率为19.1%,而已经获得批准的只有16个。
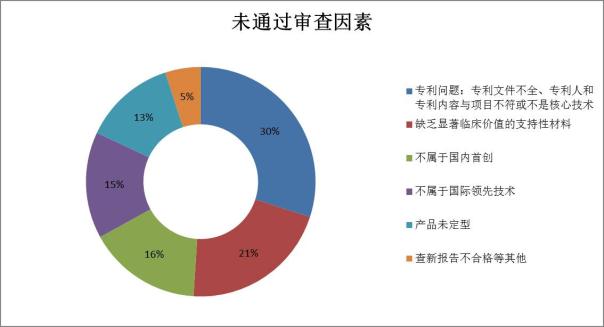
数据来源:总局医疗器械技术审评中心
归结起来原因主要有两大方面:1、产品本身不符合特批程序规定的要求;2、企业提交的材料不足以证明其产品满足要求。不管具体原因如何,较低的审批通过率折射出我国医疗器械乃至整个医疗健康行业存在的问题,即创新性不够,且急功近利。
既然要申报特别审批,自然打铁还需自身硬。只有符合《创新医疗器械特别审批程序(试行)》对于创新医疗器械的相关规定,才有可能成功通过这座不怎么宽阔的桥。
那么,什么样的器械才能称得上“创新”呢?
参考《创新医疗器械特别审批程序(试行)》以及官方公布的未通过审查的原因,创新医疗器械的定义要求必须符合:
1.依法拥有核心技术发明专利;
2.国内首创;
3.国际领先;
4.显著的临床应用价值;
5.产品基本定型。
在确定了产品符合要求以后,需要充分准备申报材料,因为所有的审评都是基于企业提交的申报材料来进行的,而且中途无法补充,因此在准备阶段务必要将申报资料准备齐全。
小结
随着2014年新版《医疗器械监督管理条例》和后续配套规章制度的实施,使得医疗器械行业发生着大变革,对企业的产品申报注册提出了更高要求,而2015年医疗器械注册收费标准出台后,器械成本又有所提高。在这样“前狼后虎”的情势下,创新医疗器械特别审批程序给出了另一种解决方案。但是,这并不意味着这就是一条捷径,企业如果想在这条路上走得顺利的话,还是那句话,打铁还需自身硬。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。