
# 热门搜索 #
君联医疗新药速递 第35期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持本周新药数据共10个,其中肿瘤7个,皮肤1个,心血管1个,代谢1个
❖第一三共和AZ联合宣布DS-8201在2期乳腺癌的治疗结果,末线治疗的ORR仍然接近61%,相当惊艳。ADC近2年在国内又呈热火燎原之势,不过主要还是集中在Her2这个先天独厚的靶点,虽然各家公司表明自己在antibody、linker和payload有独到的地方,但仍然有呈红海的趋势。DS8201这次在群雄环伺中突围而出,确实让人惊喜,但这是因为1个抗体带8个低毒的小分子还是因为潜在的IO效应,原因仍不甚明朗。在这种MoA缺乏明确区分度的赛道,后续进入的企业若仍想进入到舞台,只能靠数据说话了。
❖ 2019年ASH年会在12月召开,精彩纷呈,除了新一代BTK抑制剂开始亮相外,双抗和CART开始呈双雄争霸局面。此前CART对于难治复发的白血病淋巴瘤,基本可以认为是最后的白马骑士,虽然价格奇高无比,但仍被视为是最后一颗子弹,而双抗虽然已经有肿瘤产品上市,但由于半衰期和成本等问题,一直被遗忘在角落,但这种局面可能要改观了。本届ASH罗氏、BMS、再生元、xencor和genmab纷纷公布了CD3-CD20和CD3-BCMA的临床结果,ORR和CR都比较惊人,这不由让吃瓜群众开始想象,若双抗能头对头击败CART会产生什么样的结果?Juno,Gilead和诺华又该如何应对?如此刺激的场面,欲知后事,只能等待下回分解了。
罗氏Tecentriq三联疗法一线治疗BRAF突变黑色素瘤3期试验达到主要终点
罗氏宣布PD-L1抑制剂Tecentriq(atezolizumab)与Cotellic(cobimetinib)和Zelboraf(vemurafenib)联用,在治疗BRAF V600突变阳性的晚期黑色素瘤患者的3期临床试验中,与活性对照组相比,达到减少疾病恶化或死亡风险的主要临床终点
Tecentriq是一种PD-L1单抗癌症免疫疗法,Cotellic是一种MEK1/2(一种有助于控制细胞生长和存活的细胞信号传导途径中的蛋白质)抑制剂,Zelboraf是一种BRAF抑制剂
3期,多中心,双盲,安慰剂对照的随机研究,研究对象是先前未经治疗的BRAF V600突变阳性、转移性或不可切除的局部晚期黑色素瘤患者,主要终点是PFS
患者的无进展生存期(PFS)产生具有临床意义的显著改善,观察到的安全性与单个药物的已知安全性一致点
FDA批准Amarin鱼油产品扩展适应症,降低特定患者心血管疾病风险
美国FDA宣布,批准使用Vascepa(icosapent ethyl)作为辅助治疗,降低甘油三酯水平高于150 mg/dL成年人的心血管疾病风险
Vascepa是由高纯度的icosapent ethyl组成,源于天然鱼油成分ω-3脂肪酸
研究对象包括年龄在45岁以上,有冠状动脉、脑血管、颈动脉和周边动脉阻塞性疾病病史的患者,或50岁以上,有糖尿病和其他心血管疾病风险因素的患者
接受Vascepa治疗的患者发生心血管事件(如中风或心脏病发作)的可能性显著降低
Keytruda三联疗法2期结果积极
BioLineRx公司在欧洲肿瘤内科学会免疫肿瘤学大会(ESMO IO)上公布了该公司开发的BL-8040与PD-1抗体Keytruda,以及化疗联用,治疗转移性胰腺癌患者的2a期临床试验结果
BL-8040是一款靶向趋化因子受体CXCR4的多肽类拮抗剂,通过抑制CXCR4的功能,BL-8040能够影响免疫细胞运输,效应T细胞的肿瘤浸润,以及减少肿瘤微环境中的免疫抑制细胞,从而将“冷”肿瘤变“热”
2a期临床试验,入组患者患有4期(Stage IV)转移性胰腺癌,而且在经过一线化疗后疾病继续进展
在能够接受疗效评估的22名患者中,7名达到部分缓解(PR),10名患者达到稳定疾病(SD),总缓解率(ORR)为32%,疾病控制率(DCR)为77%。这一数值优于目前的二线标准化疗(ORR为17%,DCR为52%)
BL-8040的作用机制
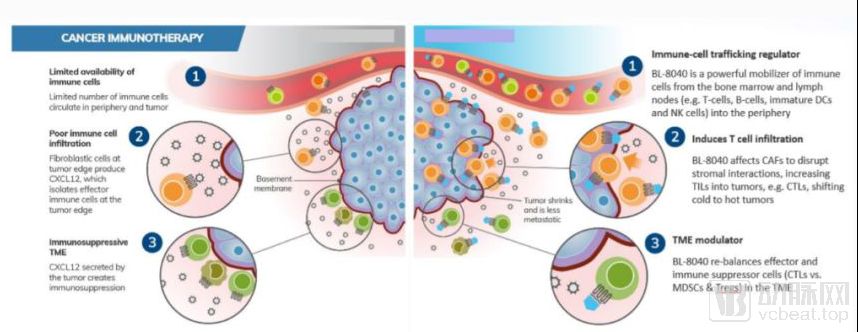
数据来源:BioLineRx
LEO制药IL-13抗体tralokinumab治疗湿疹达到3项关键性3期临床试验终点
LEO Pharma A/S公司宣布,全人源化IL-13单克隆抗体tralokinumab,在3项治疗中重度特应性皮炎(湿疹)成人患者的关键性临床试验中,达到所有主要和次要临床终点
Tralokinumab是一款IL-13单克隆抗体
三项关键性3期临床试验,入组适于接受全身性疗法的中重度特应性皮炎患者,检验tralokinumab作为单药疗法的疗效和安全性
在3项治疗中重度特应性皮炎(atopic dermatitis,又名湿疹)成人患者的关键性临床试验中,达到所有主要和次要临床终点,在未来的科学会议上公布这些试验的详细结果
Sarepta Therapeutics公司的Vyondys 53(golodirsen)获FDA加速批准
FDA宣布加速批准Sarepta Therapeutics公司的Vyondys 53(golodirsen)上市,治疗适于使用外显子53跳跃治疗的杜兴氏肌营养不良症(DMD)患者,大约占DMD患者总数的8%
Vyondys 53是一种磷酰二胺吗啉代寡聚核苷酸。它靶向抗肌萎缩蛋白mRNA前体的剪接过程,引入外显子53跳跃,旨在产出截短但仍具有功能的抗肌萎缩蛋白
两部分的临床研究进行疗效评估。第一部分包括12名DMD患者,8名患者接受Vyondys 53的治疗,4名接受安慰剂治疗。第二部分为开放标签试验,包括第一部分的12名患者和13名新的DMD患者
接受>48周治疗后,患者平均肌萎缩蛋白水平从正常水平的0.1%(基线)提高的正常水平的1.02%
Kite的CAR-T疗法KTE-X19递交上市申请
吉利德科学旗下Kite公司在刚刚结束的ASH年会上宣布,其靶向CD19的CAR-T疗法KTE-X19向美国FDA递交了该疗法的生物制品许可申请(BLA)
KTE-X19是一款靶向CD19的自体CAR-T疗法。它使用了包含T细胞筛选和淋巴细胞富集的XLP制造工艺
入组MCL患者,其此前已经接受过5种前期治疗,包括化疗,抗CD20单克隆抗体疗法,BTK抑制剂ibrutinib或acalabrutinib,但患者产生耐药性或疾病复发
在60名可以评估疗效的MCL患者中,患者疾病的总缓解率(ORR)达到93%,其中67%达到完全缓解(CR)
Seattle Genetics的HER2特异性TKI达到3期临床终点
Seattle Genetics公司宣布,其HER特异性口服小分子酪氨酸激酶抑制剂tucatinib,在治疗HER2阳性转移性乳腺癌患者的关键性3期试验HER2CLIMB中,达到试验的主要和关键性次要终点
Tucatinib是一种口服的酪氨酸激酶抑制剂,对HER2具有高选择性,但对同属人表皮生长因子受体家族的EGFR没有明显抑制作用
随机双盲含活性对照,旨在比较tucatinib联合标准治疗药物曲妥珠单抗和卡培他滨,与曲妥珠单抗和卡培他滨联用相比,在治疗局部晚期不可切除或转移性HER2阳性乳腺癌患者中的疗效与安全性。入组患者已接受过曲妥珠单抗,帕妥珠单抗和T-DM1的治疗,并有47%携带脑转移瘤
加入tucatinib的三联组合疗法显著提高患者的无进展生存期(PFS),与活性对照组相比,将患者的疾病进展或死亡风险降低46%,达到试验的主要终点
阿斯利康和第一三共重磅ADC疗法达到临床主要终点
阿斯利康和第一三共(Daiichi Sankyo)公司联合宣布,双方共同开发的抗体偶联药物(ADC)trastuzumab deruxtecan(DS-8201),在治疗HER2阳性转移性乳腺癌患者的关键性2期试验DESTINY-Breast01中,达到主要研究终点
DS-8201是靶向HER2的创新ADC,它将靶向HER2受体的全人源化单克隆抗体trastuzumab通过四肽接头与一种新型拓扑异构酶1抑制剂连接在一起。这款ADC能够在抗体上连接更多的细胞毒素,从而可能具有更好的杀伤肿瘤的效果
关键性2期临床研究,参与该试验的184名患者平均接受过6种前期疗法,其中包括ado-trastuzumab emtansine (T-DM1),trastuzumab,pertuzumab等
接受DS-8201治疗的患者达到60.9%的客观缓解率(ORR),和97.3%的疾病控制率(DCR)。患者的中位缓解时间(DOR)为14.8个月,中位无进展生存期(PFS)为16.4个月
Forty Seven的CD47靶向疗法初步临床结果积极
Forty Seven公司在第61届美国血液学会(ASH)年会上宣布,其靶向CD47的单克隆抗体magrolimab,与azacitidine组成的联合疗法,在治疗骨髓增生异常综合症(MDS)和急性髓系白血病(AML)患者的1b期试验中,表现出优于azacitidine单药疗法的治疗效果
magrolimab是一款以CD47为靶点的单克隆抗体。CD47为癌细胞上过度表达的免疫调节分子,是癌细胞为了避免被巨噬细胞吞噬而发出的“别吃我”信号
b期临床试验,旨在验证magrolimab与azacitidine联合治疗不适合化疗的高风险MDS患者和初治AML患者中的疗效
患者的总缓解率(ORR)达到92%,其中50%的患者达到完全缓解(CR),33%的患者达到骨髓形态学CR,8%的患者的血液学数据得到改善,8%的患者病情保持稳定
罗氏CD20-CD3双特异性抗体初步临床结果积极
罗氏(Roche)公司旗下基因泰克(Genentech)公司,在第61届ASH年会上,公布了该公司开发的两款CD20-CD3双特异性抗体的临床试验结果。这两款双特异性抗体分别名为mosunetuzumab和CD20-TCB,它们能够起到T细胞连接器(T-cell engager)的作用
Mosunetuzumab和CD20-TCB一方面可以靶向B细胞表面表达的CD20抗原,另一方面可以结合T细胞表面的CD3受体。它们可以将患者的T细胞募集到B细胞周围,并且激活T细胞消灭B细胞
1/1b期临床试验中,mosunetuzumab作为单药,治理R/R NHL患者,其中包括曾经接受过CAR-T细胞疗法治疗,但是疾病复发或者对CAR-T疗法产生耐药性的R/R NHL患者
mosunetuzumab在惰性NHL患者中达到62.7%(n=42/67)的客观缓解率(ORR),在侵袭性NHL中达到43.3%(n=46/124)的ORR。完全缓解(CR)率分别为43.3%(惰性NHL)和19.4%(侵袭性NHL)。在曾经接受过CAR-T疗法的患者中,ORR为38.9%(n=7/18),CR为22.2%(n=4/18)
CD20-TCB的抗体结构
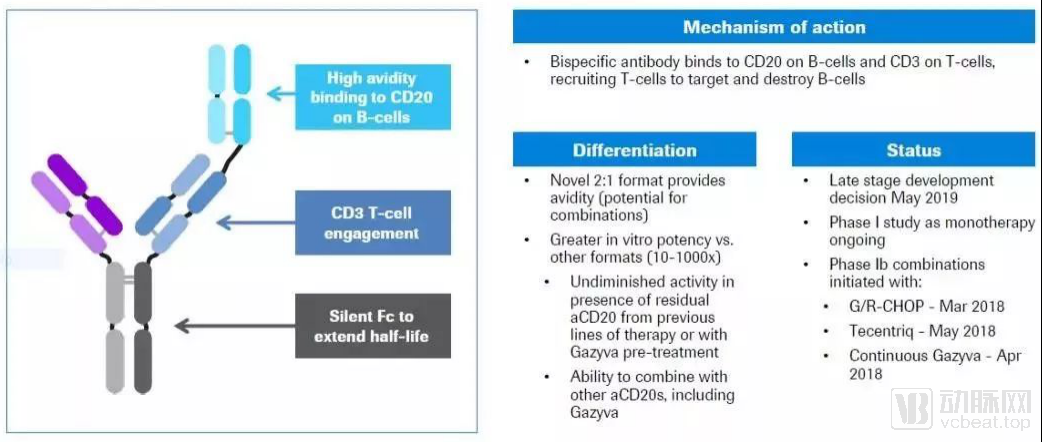
数据来源:Roche
❖ Blueprint Medicines公司在ASH年会上宣布其口服KIT和PDGFRα抑制剂avapritinib,在治疗惰性系统性肥大细胞增多症患者的2期试验PIONEER中取得优秀的初步临床数据。Avapritinib不同剂量组中患者的血清类胰蛋白酶水平得到显著且快速的降低
❖BMS公司在ASH年会上宣布,其CC-486作为维持疗法,在治疗急性髓系白血病患者的3期关键性试验QUAZAR AML-001中,与安慰剂相比,使患者的总生存期和无复发生存期达到统计学和临床意义上的显著改善
❖ASH2019年会上,赛诺菲公布了sutimlimab治疗原发性冷凝集素病关键III期临床研究CARDINAL(NCT03347396)的数据。结果显示,研究达到了主要终点和次要终点。Sutimlimab具有新颖的作用机制和高度的靶点特异性,可选择性地抑制疾病过程中经典补体途径的上游,同时保留完整的替代补体途径和凝集素补体途径及其免疫监视功能
❖基因疗法公司FerGene宣布,基因疗法nadofaragene firadenovec,在治疗对卡介苗响应不佳的晚期高级非肌层浸润性膀胱癌患者的3期临床试验中,达到主要临床终点。Nadofaragene firadenovec是一种基于腺病毒载体的基因疗法,需要每3个月通过导管灌注的方式,将含有干扰素α-2b转基因的腺病毒载体递送至膀胱
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。