
# 热门搜索 #
FDA近三年批准的121款数字医疗产品盘点,人工智能、慢病类应用、远程医疗类排前三
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持创新设计、智能研发和临床验证都是推出一款医疗产品的关键步骤,但如果没有监管机构的认证,许多创新产品将永远没有机会面向患者和消费者。
近年来,数字医疗的快速发展催生出了许多相关产品。在美国,负责监管的FDA(食品药品监督管理局)不断推出新计划、改革现有规定,旨在简化审批新产品的流程,开拓数字医疗市场。
动脉网(微信:vcbeat)梳理了FDA对数字医疗产品的监管历程。本文的主要内容包括:
1.盘点:2016-2018年FDA认证的数字医疗产品
2.回顾:FDA如何监管数字医疗技术和产品?
截至目前,2018年共有41款数字医疗产品获得了FDA认证。
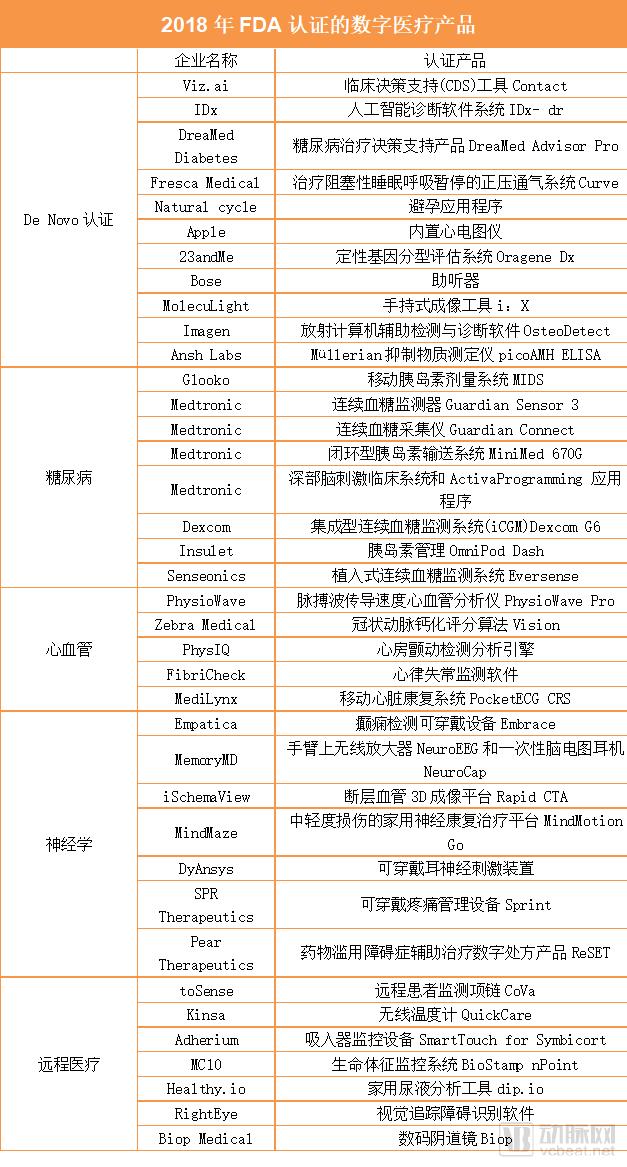
第一大类:De Novo认证(自动化III类指定评估)
1.2018年2月,FDA宣布允许Viz.ai 's Contact上市。Viz.ai 's Contact是一种临床决策支持(CDS)工具,用于分析CT结果,并判断患者是否患过中风。
2.2018年4月,FDA批准了诊断公司IDx的De Novo申请,允许其基于人工智能的软件系统IDx- dr进入市场,用于自动检测成年患者的糖尿病视网膜病变。这一决定标志着FDA首次批准基于人工智能的诊断系统在美国上市,该系统无需临床医生诊断就可提供检测结果。
3.以色列公司DreaMed Diabetes推出的糖尿病治疗决策支持产品DreaMed Advisor Pro也获得了FDA的De Novo认证。基于云计算的DreaMed Advisor Pro是一款助患者管理1型糖尿病的人工智能软件,它可以分析来自连续血糖监测器、胰岛素泵和自我监测器的数据,以确定输送胰岛素的含量。
4.互联医疗公司Fresca Medical获得了FDA的De Novo认证,可以销售其名为Curve的设备,这是一种治疗阻塞性睡眠呼吸暂停的正压通气系统。Curve包括流量发生器、轻量级的人体工程学空气输送软管和鼻枕。不同于其他同类产品,该设备采用的是SmartValve技术,这种技术比其他系统使用的气流更少,可帮助睡眠呼吸暂停综合症的患者依从性更高。
5.Natural cycle的避孕应用程序获得了FDA的批准,可向18岁以上绝经前女性销售此款产品。这款由算法驱动的应用程序此前在英国获得批准,目前正接受多个监管机构的审核。它通过在早上测量体温并提交关于月经周期的信息,帮助用户追踪月经周期,并告知她们什么时候最容易受孕。
6.苹果公司在第四代Apple Watch中内置心电图仪,这一功能已获得FDA的认证。用户需要大约30秒的时间来做心电图,然后将心电图存储在苹果的健康应用程序中。通过Apple Health Records,一些用户还可以直接向医生发送数据。此外,FDA还批准了苹果公司一项检测心房颤动的算法。除了心电图,它还能让手表在后台扫描用户的心律,如果发现心律不正常,它就会发出通知。
7. 23andMe个人基因组服务(PGS)是一种定性基因分型评估系统,应用于使用Oragene Dx OGD 500.001收集的人唾液中分离的基因组DNA,以便在广泛的多基因检测中同时检测、报告和解释遗传变异。该评估系统旨在使用户能够直接访问有助于与医疗保健专业人员讨论的遗传信息。
8. Bose助听器旨在为18岁或18岁以上的轻度至中度听力障碍患者提供声音,用户可以根据需求对Bose助听器进行自主调整,但无需预编程或听力测试。FDA将Bose助听器分类为自适应空气传导助听器下的II类医疗器械,可用于直接销售和使用,而无需听力保健专业人员的协助。
9. MolecuLight i:X是一种手持式成像工具,允许临床医生诊断和治疗皮肤伤口,并且仅供处方使用。按照FDA要求,MolecuLight i:X 可以用于查看和以数字方式记录伤口图像,观察并以数字方式记录当伤口暴露于激光环境中时,伤口所形成的荧光图像。
10. OsteoDetect使用机器学习技术分析腕部X光片,实现在复查前后路(PA)和外侧(LAT)X线片中,识别并突出显示成人手腕桡骨远端骨折在的目的。FDA认为OsteoDetect属于放射计算机辅助检测与诊断软件,并将其归类为II类医疗器械。
11. picoAMH ELISA用于体外的酶联免疫吸附测定(ELISA)抗苗和勒管激素(AMH,也称为Müllerian抑制物质(MIS))在人血清中浓度的定量测量。前述物质能够显著作用于42至62岁女性的绝经状态。FDA要求picoAMH ELISA应该与其他临床和实验室检查结果以及该检测结果一起使用,不能单独应该用于做出诊断或治疗决定。此外,FDA规定picoAMH ELISA仅能凭处方用于体外诊断用途。
第二大类:糖尿病
12.糖尿病数字健康公司Glooko旗下的移动胰岛素剂量系统(MIDS)已获得FDA的认证,该系统是一种应用程序驱动的工具,可直接根据从患者血糖仪收集的数据调整胰岛素剂量。MIDS允许临床医生创建一个定制的治疗计划,并通过应用程序发送给2型糖尿病患者。
13Medtronic公司2018年获得了FDA的四次批准,第一次是增加了Guardian Sensor 3的功能,允许患者将传感器戴在上臂。该传感器是MiniMed 670G系统的一部分,也是目前唯一一个通过FDA批准的连续血糖监测器,它通过混合闭环系统控制胰岛素的自动输送。
14.第二项获得认证的产品是Guardian Connect。这款产品可以连接智能手机,用于每天多次注射胰岛素的患者。Guardian Connect系统由Guardian Sensor 3和附属发射器组成,可以通过蓝牙将连续采集的血糖数据发送到用户手机上,相关应用程序可以在发生高血糖或低血糖60分钟前提醒患者。
15.第三次是允许MiniMed 670G向7岁至14岁的1型糖尿病儿童开放,该产品是一种闭环型胰岛素输送系统。2016年,MiniMed 670G成为首个获得FDA批准的连续血糖监测系统,但当时FDA规定只有14岁以上的患者才可以使用。
16.第四项获得认证的产品是深部脑刺激(DBS)临床系统和ActivaProgramming 应用程序。DBS系统通过手术植入患者的大脑,向选定区域提供电刺激。ActivaProgramming应用程序可以简化工作流程,为神经学家和神经外科医生提供可操作的信息。
17.Dexcom推出的集成型连续血糖监测系统(iCGM)Dexcom G6是第一个获批的可互操作的连续血糖检测系统,也是FDA认可的唯一一种iCGM,可与其他兼容的医疗设备和电子接口集成,如自动胰岛素给药系统、胰岛素泵、血糖仪等糖尿病管理电子设备。
18.FDA批准Insulet Corporation的产品OmniPod Dash胰岛素管理系统进入市场。该产品包括一个可穿戴的胰岛素泵,可以通过控制基础速率和用量帮助患者进行治疗。Dash系统还包括一个带有触摸屏的手持个人糖尿病管理器,可以通过蓝牙与pod连接。
19.Senseonics推出的植入式连续血糖监测系统Eversense获得了FDA的批准,将在美国上市。该公司已经在欧洲、中东和非洲销售其第二代设备。
第三大类:心血管
20.斯坦福大学所属的PhysioWave推出的脉搏波传导速度(PWV)心血管分析仪PhysioWave Pro获得了FDA的认证,该产品可用于监测从心脏向身体输送血液的血管、脉搏和体重,以判断用户是否患有心血管疾病。
21.以色列的深度学习初创公司Zebra Medical Vision获得了FDA 的510(k)认证,该公司的冠状动脉钙化评分算法(Coronary Calcium Scoring algorithm)可以通过电子计算机断层扫描,帮助医生量化患者冠状动脉钙化的程度。
22.PhysIQ公司推出的一款心房颤动检测分析引擎获得了FDA的批准,可用于患者护理和临床试验。该引擎可与PhysIQ公司其他获批产品共同使用,提供数据分析。
23.FibriCheck宣布其应用程序获得FDA的 510(k)认证,该程序使用智能手机的摄像头和人工智能来监测心律失常。该公司预计将在2019年将其产品推向美国市场。
24.Medicalgorithmics的子公司MediLynx推出的移动心脏康复系统PocketECG CRS获得了FDA的 510(k)认证。该产品基于PocketECG技术,可以在30天远程监控心律失常患者。PocketECG CRS还包括一个内置的加速度计和一个触摸屏,可将数据传送到在线监测平台和医生门户网站。
第四大类:神经学
25.Empatica的Embrace是一款检测癫痫的可穿戴设备,今年1月获得FDA 的510(k)认证。这款产品已经被制药公司Sunovion用于临床试验,但使用者必须从神经科医生那里获得处方,才能使用这种设备的癫痫检测功能。
26.MemoryMD公司推出的两款产品——NeuroEEG和NeuroCap都获得了FDA的认证。NeuroEEG是一种戴在手臂上无线放大器,可以通过蓝牙将脑电图信号传送到电脑和云端数据库。NeuroCap是一款19通道一次性脑电图耳机,两款产品可以配合使用。
27.脑血管成像公司iSchemaView旗下产品Rapid CTA是用于计算机断层血管成像(CTA)的3D成像平台。而CTA扫描可以帮助临床医生可视化患者的大脑动脉。
28.2018年6月,MindMaze公司获得了FDA对MindMotion Go的认证,这是一个针对中轻度损伤的家用神经康复治疗平台。使用基于微软Kinect的动作捕捉技术,该产品可以让患者在3D环境中进行一系列活动,以促进康复。
29.医疗设备公司DyAnsys推出的可穿戴耳神经刺激装置已获得FDA批准,可用于治疗阿片类药物停药症状。
30.SPR Therapeutics公司推出了可穿戴疼痛管理设备——Sprint外周神经刺激(PNS)系统,更新后的平台支持可充电电池以及配有蓝牙的控制器。
31.Pear Therapeutics公司旗下产品ReSET成为FDA批准的首款数字处方产品,将用于兴奋剂、大麻、可卡因或者酒精等药物滥用障碍症的辅助治疗,帮助患者重新控制药物上瘾症。
第五大类:远程医疗
32.toSense公司的CoVa监测系统是一款远程患者监测项链,今年获得了FDA的第二次批准,允许该公司更新软件,在原有产品上增加新功能,即测量脑卒中梗塞体积和输出量。此外,还允许设备连接到一个移动应用程序,该程序允许医疗专业人员远程查看测量数据。
33.互联健康公司Kinsa推出了一款名为Kinsa QuickCare的无线设备。QuickCare温度计可以在8秒内读取温度,而且保留了先前产品Smart Stick的大部分软件功能。
34-37.智能吸入器公司Adherium获得了FDA的 510(k)认证,可销售其用于阿斯利康Symbicort气雾剂吸入器的吸入器监控设备—— SmartTouch for Symbicort。该装置可以安装到患者的吸入器上,用于监测和改善药物依从性,帮助临床医生查明患者何时以及如何误用吸入器。几个月后,Adherium推出的针对ProAir HFA、Ventolin HFA和Flovent HFA吸入器的其他产品也获得了FDA的非处方许可。
38.传感器制造商MC10推出的BioStamp nPoint系统首次获得FDA 的510(k)认证。该系统由可重复使用的传感器贴片组成,可以24小时监控用户。该传感器可以记录各种生命体征,比如运动和心率等,并将相关数据显示在同样由MC10公司提供的手机上。
39.以色列公司Healthy.io推出的dip.io也获得了FDA的 510(k)认证。该产品是一款家用尿液分析工具,它可以让智能手机的摄像头在不受灯光或环境的影响下准确读取测试条。
40.初创公司RightEye旗下的基于云计算的追踪系统和软件获得了FDA 的510(k)认证。该系统和软件通过记录、观察和分析患者的眼睛,帮助临床医生识别患者的视觉追踪障碍。其主要功能包括功能性视力筛查、阅读评估、运动视力评估、训练和大脑健康。
41. Biop的数字阴道镜,设计用于放大观察阴道,子宫颈和外生殖器,使医生能够识别病变或癌症等异常情况,并选择活检区域。Biop的系统由两个主要单元组成:数字阴道镜单元,连接到主控制单元。将Biop的数字阴道镜单元连接到控制单元,可以对子宫颈进行全数字化和高分辨率成像,并可以在彩色触摸屏上查看图像。
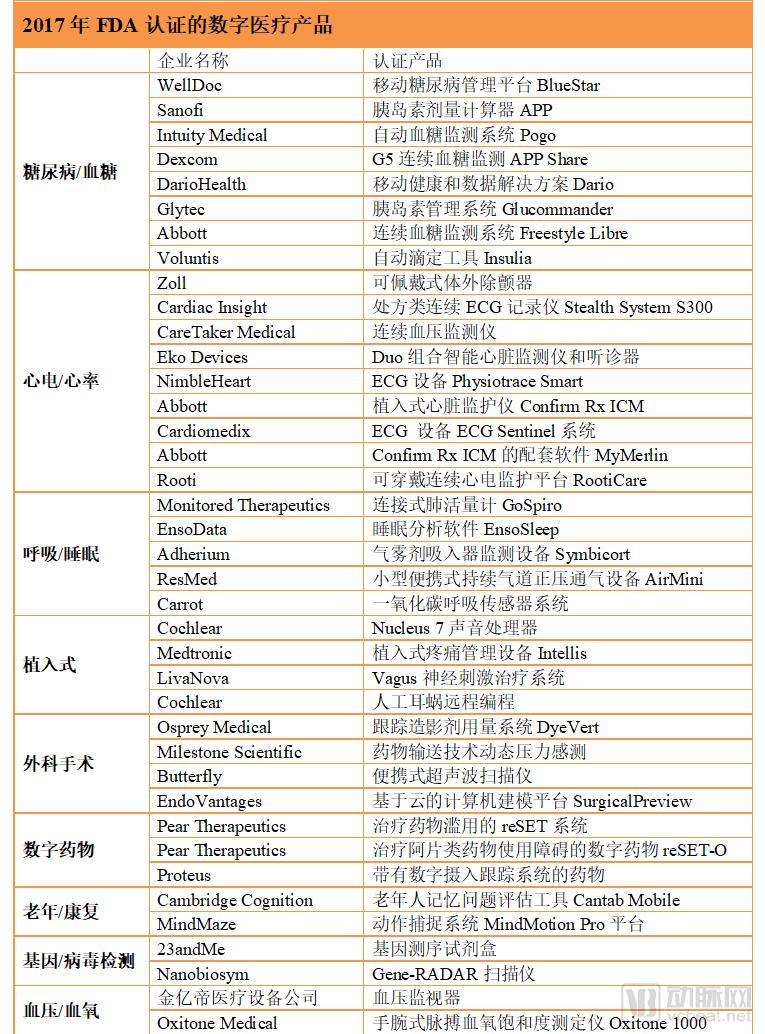
2017年,共有43款创新型数字医疗产品获得FDA的认证,糖尿病管理产品和心电信号监测产品占据较大比例。
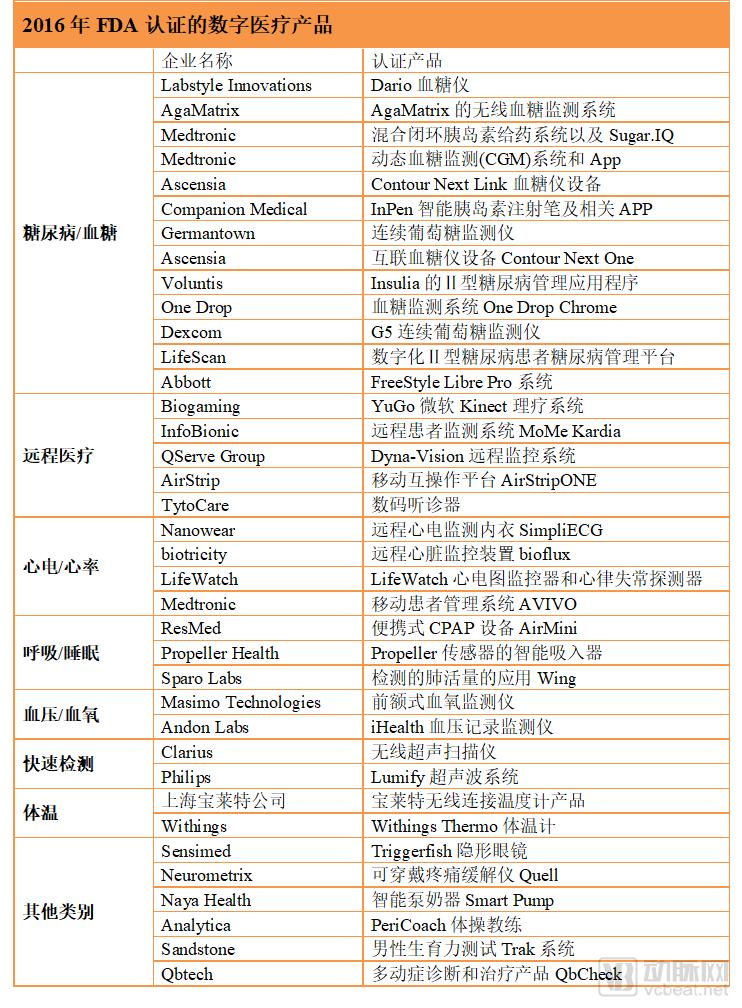
2016年,共有37款数字医疗产品获得FDA的认证,其中最多的是血糖/糖尿病类产品。
2013年9月,FDA正式公布“移动医疗应用指导最终版”(Mobile Medical Application Final Guidance),标志着移动医疗在发展上开始有初步的依循规范,为之后数字医疗的发展奠定了基础。
根据FDA的规定,需要被监管的医疗设备/器械分为3类:
1. I类——低风险,受一般控制。I类医疗设备是可以连结并控制一个或多个医疗设备,或是显示、储存、分析、传送特定患者数据的医疗设备。
2. II类——中度风险,受一般控制和特殊控制。II类医疗设备是可以藉由配件、显示器、传感器或是现行已受法规规范的医学设备具备的功能,让移动装置可以转变成受法规规范的移动医疗装置
3. III类——高风险,受一般控制和上市前批准。III类医疗设备可以执行特定患者的数据分析、提供特定患者的诊断或治疗建议。
在对设备进行分类之后,需要进行相应的申请。最常见的上市前申请类型包括:
1.510(k)(上市前通知);
2.PMA(上市前批准);
3.De Novo(自动化III类指定评估);
4.HDE(人道主义豁免设备);
2017年7月,FDA发布了“数字健康创新计划”(Digital Health Innovation Action Plan, DHIAP ),包括颁布新法规实施相关的指导原则、重构数字健康产品监管体系和增长专业知识三个方面。其中阐述了对于确保高质量、安全和有效的数字医疗的指示,并宣布该计划与《作为医疗器械的软件指南》(Software as a Medical Device (SaMD) guidance)目的一致。
截至2017年底,FDA已初步完成了一些“数字健康创新计划”中比较重要的工作。其中,“临床和患者决策支持软件”指导原则草稿、“21世纪治疗法案3060章导致的已有医疗器械软件政策的修改”指导原则草稿和“作为医疗器械管理的软件:临床评价”指导原则终稿,是对21世纪治疗法案中的一些重要条款进行的阐述,并明确了FDA在数字健康领域中所扮演的角色。
2017年7月,FDA还公布关于数字健康软件预认证(Pre-certification , PreCert)计划的决定。FDA的预认证试点表明FDA将选择并预先认证特定的数字健康开发商,例如经过客观标准评估的企业,这些客观标准包括软件开发/设计的进步,以及对软件开发进行有效验证并确保质量。经过预认证后,该数字健康开发商生产的低风险移动医疗产品将不必进行额外的FDA审评,或采取简化审评流程。
2018年11月,FDA宣布将对 510 (k)申请规定进行改革。510(k)文件是向FDA递交的上市前申请文件,目的是证明申请上市的器械与不受上市前批准(PMA)影响的合法上市器械同样安全有效,即为等价器械(substantially equivalent)。FDA宣布将在2019年推出一个全面替代510(k)的新审批路径。对于前基设备(predicate device)则会考虑设置10年的时间限制。
2018年12月,FDA提出了De Novo申请的新草案。在美国,对于没有合法上市对比产品的器械,即使属于中低风险,仍然无法通过510(k)申请途径建立实质等同,获得上市许可。针对这类产品,FDA于多年前建立了De Novo申报途径,对产品进行普通控制或特殊控制,避免按照最高类别III类申报,给企业降低负担,以便患者能够及时获得安全有效的器械。
FDA本次发布的De Novo分类规则新草案更加透明有效地阐明了在该路径中提交文件的需求和FDA审核的过程,例如,拟议的法规和要求将提供关于重新分类过程的结构、清晰度和透明度,包括与重新分类请求的格式和内容有关的要求,以及接受、批准、拒绝和撤回重新分类请求的过程和标准。如果最终确定,将有助于对新型医疗设备进行适当分类,使设备开发商能够利用这一路径开发更多的新型设备。
参考资料:
2.https://vcbeat.top/ZTMwMDEyZWI2MTAyNDg4N2E0OWNmOTgxNzczOTNhZmE=
3.https://vcbeat.top/MTkyMDA0MGFlZDVlMjA1ZDA3M2MzZmZjOGQzNTAzNTk=
4.http://www.appliedclinicaltrialsonline.com/look-fda-s-digital-health-action-plan
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。