
# 热门搜索 #
君联医疗新药速递 第36期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
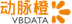 提供支持
提供支持
本周新药数据共8个,其中肿瘤4个,风湿免疫2个,疫苗1个,神经1个
❖ Seattle Genetics针对Her2的TKI tucatinib获得突破性疗法认定,用于联用治疗晚期或转移性乳腺癌患者。在名为HER2CLIMB的3期试验中,实验组的OS得到显著提升(21.9月vs17.4月),其中47%的脑转移患者亚组PFS也有优秀表现,疾病进展或死亡风险降低52%。在Her2阳性乳腺癌的小分子赛道,不少公司都尝试在脑转移瘤进行突破(相对大分子赫赛汀容易做出优势),但由于血脑屏障的存在,一直没有重磅级的产品出来,该领域仍然存在巨大的未被满足的临床需求。PUMA的来那替尼曾经被寄予厚望,但由于将近40%的患者出现3级以上的严重腹泻,一定程度上限制了商业推广。目前国内不少公司都在该领域下注,期待能有更优秀的成果出来。
❖ 吉利德向FDA提交口服JAK1抑制剂filgotinib的上市申请,用于中度至重度RA的治疗,吉列德同时还用了一张优先审评券,预计可缩短审查时间。filgotinib是高度选择性的JAK1抑制剂,由Galapagos发现和开发,吉利德于2015年12月底与Galapagos达成了总额高达20亿美元的协议。目前在JAK抑制剂领域,辉瑞的Xeljanz和礼来的Olumiant已经上市,属于pan-JAK,但艾伯维的upadacitinib是能与filgotinib头对头竞争的高选JAK1,而且艾伯维使用了一张优先审评券(3.5亿美元购买)加速upadacitinib的审批,目前upadacitinib已成功获得美国和欧盟批准上市。JAK和BTK属于近3年小分子领域的重磅靶点,各自在实体瘤和液体瘤领域不断开疆拓土。目前BTK已经开始国产化,预计未来也会很快出现本土的高选JAK。
阿斯利康/第一三共乳腺癌ADC获FDA加速批准
FDA宣布,加速批准第一三共(Daiichi Sankyo)和阿斯利康(AstraZeneca)共同开发,靶向HER2的抗体偶联药物(ADC)Enhertu(fam-trastuzumab deruxtecan-nxki,曾用名DS-8201)上市,治疗无法切除或转移性HER2阳性乳腺癌患者
Enhertu是一款ADC药物,使用了第一三共称为DXd ADC的技术平台,在ADC的细胞毒性药物和连接子上作出了多种技术创新
2期临床研究,参与该试验的184名患者平均接受过6种前期疗法,其中包括ado-trastuzumab emtansine (T-DM1),trastuzumab,pertuzumab等
接受DS-8201治疗的患者达到60.9%的客观缓解率(ORR),和97.3%的疾病控制率(DCR)。患者的中位缓解时间(DOR)为14.8个月,中位无进展生存期(PFS)为16.4个月
DXd ADC的技术平台
数据来源:第一三共
百时美施贵宝CAR-T疗法递交监管申请治疗大B细胞淋巴瘤
百时美施贵宝(BMS)向美国FDA递交了靶向CD19抗原的CAR-T疗法lisocabtagene maraleucel(liso-cel)的生物制品许可申请(BLA),治疗复发/难治性(R/R)大B细胞淋巴瘤(LBCL)
Liso-cel是一款靶向CD19抗原的自体CAR-T疗法,独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制,从而可以更好地控制细胞疗法的毒副作用
入组难治/复发性大B细胞淋巴瘤患者,主要终点为ORR和CR
总缓解率达到73%,其中53%的患者达到完全缓解
UroGen Pharma膀胱癌突破性疗法获优先审评资格
UroGen Pharma公司宣布,FDA已接受其凝胶药物UGN-101的新药申请,用于治疗低级别上尿路上皮癌患者,同时授予该药物优先审评资格,预计将在明年4月18日作出回复
UGN-101是一种凝胶药物,有效成分是丝裂霉素,可以通过标准的膀胱内导管滴注到患者的病灶处,在室温呈液态,在体温环境下凝结成半固态;这一特性能够保持滴注在病灶处药物的持续释放,让尿路组织能够长期暴露在丝裂霉素的作用之下,从而使用非手术方法消除肿瘤
纳入71名患者的3期临床试验,34名患者的肿瘤属于无法通过手术切除的类型
在总意向治疗患者组中,59%接受UGN-101治疗的患者达到了完全缓解(CR),89%的患者的缓解持续时间(DOR)达到6个月,84%的患者DOR达到12个月, 在无法通过手术切除肿瘤的患者亚组中,患者CR与DOR达到12个月的比例与总意向治疗患者组的结果相同
吉利德使用优先审评券递交JAK1抑制剂新药申请
吉利德科学(Gilead Sciences)公司宣布,向美国FDA递交了JAK1抑制剂filgotinib的新药申请(NDA),用于治疗中重度类风湿关节炎成人患者,该公司使用了优先审评券
Filgotinib是吉利德科学和Galapagos公司联合开发的JAK1选择性抑制剂。JAK激酶依赖性细胞因子与许多炎症性和自身免疫性疾病的发病机制相关
随机双盲,含安慰剂和活性对照,已经接受过MTX治疗,但是反应不良的患者接受了filgotinib,安慰剂或adalimumab的治疗。所有患者同时继续接受MTX治疗
12周之后,接受filgotinib治疗的患者中达到ACR20(美国风湿病学会疗法评估指标之一)的患者比例显著高于安慰剂组,达到了试验的主要终点
FDA批准首个埃博拉病毒疫苗上市
美国FDA批准默沙东的Ervebo疫苗上市,用于预防在18岁以上的人群中预防由于扎伊尔埃博拉病毒感染导致的埃博拉病毒病,这是FDA批准的首个预防埃博拉病毒病的预防性疫苗
Ervebo是一种经过基因工程改造的减毒活疫苗,由改造过的水疱性口炎病毒(VSV)和埃博拉病毒表面的重要糖蛋白组成
2014-2016年在几内亚EVD爆发时开展的一项研究,是随机分组疫苗接种研究,其中3537名埃博拉病毒暴露人员和接触经实验室确诊EVD的暴露人员,接受了“立即”或21天“延迟”接种Ervebo
在对“即时”接种组的2108名个体和“延迟”接种组的1429名个体的EVD病例的比较中,Ervebo被确证在“即时”接种组中未观察到EVD症状发作病例,接种后10天(含)以上没有出现埃博拉病例记录,100%有效;与之相比,在21天“延迟”组中观察到10例EVD病例
Seattle Genetics和安斯泰来联合开发的ADC上市
美国FDA批准Seattle Genetics公司和安斯泰来(Astellas)公司联合开发的Padcev(enfortumab vedotin-ejfv)上市,治疗局部晚期或转移性尿路上皮癌患者
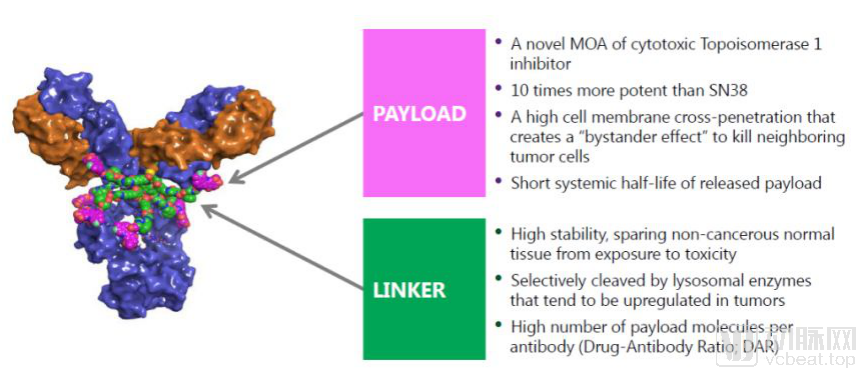
Padcev是将抗Nectin-4单克隆抗体与微管抑制剂偶联起来的抗体偶联药物。Nectin-4蛋白是在尿路上皮癌中高度表达的细胞粘附分子
入组尿路上皮癌患者,使用Padcev治疗,此前他们都接受过铂基化疗和PD-1/PD-L1抑制剂的治疗
患者的总缓解率达到44%,其中完全缓解率为12%,部分缓解率为32%。中位缓解持续时间为7.6个月
Padcev的作用机理
数据来源:Seattle Genetics
GSK红斑狼疮疗法达到3期终点
GSK宣布,其静脉输注疗法Benlysta(belimumab)在治疗狼疮性肾炎(LN)患者的3期试验BLISS-LN中,达到试验的主要和所有次要终点。葛兰素史克计划于2020年上半年递交该适应症的监管申请
Benlysta是一款人源化的单克隆抗体,能够特异性地与B淋巴细胞刺激因子(BLys)结合,抑制B细胞的生存。能够有效抑制自身反应性的B细胞,并让B细胞不容易分化成生产免疫球蛋白的浆细胞
随机,双盲,含安慰剂对照组的3期临床试验。试验的主要终点为达到初级肾脏缓解(PERR)标准的患者比例
治疗两年后,43%接受Benlysta与标准疗法联用的患者达到PERR,这一数值显著高于接受安慰剂与标准疗法治疗的患者(32%,p=0.0311)
Axsome Therapeutics抑郁症新药达到3期主要终点
Axsome Therapeutics公司宣布,其口服创新NMDA受体拮抗剂AXS-05,在治疗抑郁症(MDD)患者的3期试验GEMINI中,使患者的抑郁症症状得到了快速且持久的显著改善,达到试验的主要终点
AXS-05是一种新型口服NMDA受体拮抗剂。它由右美沙芬(dextromethorphan)和安非他酮(bupropion)构成,并且使用了Axsome公司的代谢抑制技术
随机双盲,含安慰剂对照组的3期临床试验,共有327名中重度MDD成年患者参与,˙主要终点为患者的抑郁症症状,次要终点包括疾病严重程度,功能障碍和生活质量等
该试验使用了蒙哥马利抑郁评定量表(MADRS)对患者进行评估,AXS-05组患者在接受治疗6周后MARDRS评分较基线时下降16.6个点,而安慰剂组中的这一数值为11.9个点
❖ 勃林格殷格翰和Pharmaxis宣布其SSAO/VAP-1抑制剂BI 1467335在最新的临床研究中虽然没有直接失败,但由于该药与其他药物发生相互作用,双方决定放弃该药用于治疗NASH适应症的研发
❖Biohaven Pharmaceutical宣布其CGRP受体拮抗剂vazegepant,在治疗急性偏头痛患者的2/3期关键性临床研究中,达到主要研究终点。Vazegepant是目前治疗偏头痛患者的首款,也是唯一一款鼻内给药的CGRP受体小分子拮抗剂
❖诺华哮喘新药fevipiprant关键性全球III期LUSTER-1和LUSTER-2研究的最新结果显示,在52周治疗期间,与安慰剂相比,两种剂量fevipiprant没有达到降低中重度恶化率的临床相关阈值
❖百济神州BTK抑制剂泽布替尼对比伊布替尼用于治疗华氏巨球蛋白血症患者的III期ASPEN临床试验数据显示,在主要终点——完全缓解和非常好的部分缓解率上,泽布替尼的治疗优势未能达到有统计学意义的优效性
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。