
# 热门搜索 #
君联医疗全球新药资讯速递 · 第23期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
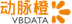 提供支持
提供支持
❖本周新药数据共10个,其中肿瘤6个,代谢、免疫、过敏疾病和CNS疾病各1个
❖ FDA正式批准诺和诺德Rybelsus(口服索马鲁肽,每日1次)的上市申请,这是基于10项PIONEER临床试验的结果,Rybelsus通过头对头的实验分别击败了西格列汀、恩格列净、利拉鲁肽,奠定了王者地位,这颇有当年立普妥横扫宇内一统江湖的风采。现在在DM治疗领域,如果产品只有降糖作用,已经根本无法出门跟人打招呼了,大家拼的是降糖以外的减重和心血管获益,而且现在有Rybelsus这种灭霸级别的boss在,biotech想再切入这个治疗领域,基本是hell级别的难度了
❖2019年9月18-22日CSCO在福建省厦门市召开,总体来说,由于很多数据都已经有剧透和预告,所以没有特别惊艳和爆炸性的内容,本届大会的主要亮点集中在免疫治疗(PD1)和肺癌精准治疗,受关注较多的讲座包括K药单药改善中国PDL1阳性NSCLC患者的OS;卡瑞利珠单抗联合化疗一线治疗非鳞NSCLC有显著获益;辉瑞的二代EGFR TKI达克替尼试图凭借OS的优势对奥希替尼进行逆袭;贝达的恩沙替尼凭借中位PFS和中枢神经系统获益对辉瑞二代ALK克唑替尼发起挑战等
美国FDA批准诺和诺德口服索马鲁肽上市,改善2型糖尿病患者的血糖控制
美国FDA批准诺和诺德口服索马鲁肽上市,与饮食和锻炼相结合,改善2型糖尿病患者的血糖控制
每日口服一次的索马鲁肽药片是第一款获得FDA批准的口服胰高血糖素样肽-1受体激动剂(GLP-1 RA)
口服索马鲁肽申请上市以及获批的依据是10项PIONEER临床试验的结果,共涉及9543例2型糖尿病患者
PIONEER项目的一系列“头对头”临床试验分别证实了口服索马鲁肽在降低HbA1c、减轻体重方面较西格列汀、恩格列净、利拉鲁肽具有显著优势,而且口服索马鲁肽具有与其他GLP-1药物一致的安全性和耐受性,最常见的不良事件主要是恶心
索马鲁肽的pioneer系列研究
数据来源:Science direct
诺华的全人源抗IL-17A单抗在治疗非放射性轴性脊柱关节炎的3期临床试验达到主要临床终点和所有次要终点
诺华的全人源抗IL-17A单抗Cosentyx(苏金单抗),在治疗非放射性轴性脊柱关节炎的3期临床试验PREVENT中,达到主要临床终点和所有次要终点
Cosentyx是首个可以直接抑制IL-17A的全人源生物制剂
555名非放射性轴性脊柱关节炎成人患者参与这一为期2年的随机,双盲,含安慰剂对照组的3期临床研究
与安慰剂相比,接受Cosentyx治疗的患者的疾病活性显著降低,且具有临床意义。在16周时,达到脊柱关节炎国际协会评定40(ASAS40)标准的患者比例显著高于对照组,达到试验的主要终点
美国FDA批准默克的Keytruda与卫材的乐伐替尼联用,治疗特定晚期子宫内膜癌患者
美国FDA批准默克的Keytruda与卫材的乐伐替尼联用,治疗特定晚期子宫内膜癌患者。这些患者不属于微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)类型
keytruda是PD1抑制剂,乐伐替尼是酪氨酸受体抑制剂
在单臂2期临床试验中,有108名转移性子宫内膜癌患者,87%(94名)患者的肿瘤不属于MSI-H或dMMR
在这94名患者中,Keytruda和Lenvima组合达到38.3%的客观缓解率(95% CI, 29%-49%),完全缓解率为10.6%,部分缓解率为27.7%
杨森宣布美国FDA已批准Erleada(apalutamide)治疗转移性去势敏感性前列腺癌(mCSPC)
强生旗下的杨森(Janssen)公司宣布,美国FDA已批准Erleada(apalutamide)治疗转移性去势敏感性前列腺癌(mCSPC)
Apalutamide(阿帕他胺)是第2代非甾体雄激素受体(AR)抑制剂
在3期随机,安慰剂对照,双盲研究中,纳入了23个国家的1,052名患者。该试验允许患者入组前接受过针对前列腺局部病灶的治疗和多西他赛(但疾病未进展)的治疗
与安慰剂+ADT相比,Erleada+ADT显著延长了OS,死亡风险降低了33%(HR=0.67;95%CI,0.51-0.89;P=0.0053)
FDA召集的过敏产品咨询委员会支持Aimmune Therapeutics开发的AR101用于治疗儿童和少年的花生过敏
Aimmune Therapeutics公司宣布,FDA召集的过敏产品咨询委员会(Allergic Products Advisory Committee, APAC)支持该公司开发的AR101(计划商品名Palforzia)用于治疗儿童和少年的花生过敏
Palforzia的原理是通过给花生过敏患者服用少量的花生蛋白,让患者的免疫系统逐渐对花生蛋白产生脱敏(desensitization)
在多项3期临床试验结果中,超过1000名患者参加了这些临床试验
接受Palforzia治疗的患者在临床试验结束时能够耐受的花生蛋白剂量显著超过安慰剂组,中位耐受蛋白剂量提高了100倍
美国FDA已经接受了Seattle Genetis研发的抗体偶联药物的生物制剂许可申请,用于治疗尿路上皮癌
Seattle Genetics和安斯泰来公司(Astellas Pharma)共同宣布,美国FDA已经接受了其共同研发的抗体偶联药物(ADC)enfortumab vedotin的生物制剂许可申请(BLA),用于治疗局部晚期或转移性尿路上皮癌患者
enfortumab vedotin是抗体偶联药物
在关键性2期临床试验中,共有128名已经接受过PD-1/L1抑制剂的治疗,和在新辅助/辅助情况下的铂基化疗患者参与这一试验
enfortumab vedotin能够在这些患者中达到44%的客观缓解率(ORR),其中12%的患者达到完全缓解(CR)
Acadia Pharmaceuticals宣布pimavanserin在3期试验中达到了主要终点,用于治疗痴呆症相关精神病
Acadia Pharmaceuticals公司宣布,其用于治疗痴呆症相关精神病(dementia-related psychosis)的pimavanserin,在关键3期试验HARMONY中,达到了主要终点
Pimavanserin是一款选择性血清素受体反向激动剂(SSIA),能够选择性地靶向5-HT2A受体
在3期试验HARMONY中,在12周的开放标签稳定期内,符合预先设定的缓解标准的患者被随机分组进入随后的双盲期,或继续接受pimavanserin,或转换到安慰剂
与安慰剂相比,pimavanserin能统计显著延长患者痴呆症相关精神病再度复发前的缓解持续时间,达到了试验的主要终点
信达生物的IBI301的2个3期试验达到主要终点
信达生物开展了IBI301在经治达到完全缓解的CD20阳性B细胞淋巴瘤患者中的药代动力学(PK)比对研究,以及在CD20阳性DLBCL初治患者中的临床有效性比对研究,3期结果显示达到主要终点
IBI301是利妥昔单抗生物类似药,为CD20单抗
在经治达到CR的CD20阳性B细胞淋巴瘤中开展的IBI301与原研药利妥昔单抗注射液的PK比对研究共入组181例受试者,IBI301组89例,原研药组92例
IBI301与原研药利妥昔单抗用于CD20阳性的B细胞淋巴瘤和DLBCL初治患者的临床疗效等效,且安全性相似
基石药业公布PD-L1抗体联合顺铂和氟尿嘧啶治疗食管鳞癌(ESCC)患者的1b期临床试验初步结果
基石药业公布PD-L1抗体CS1001联合顺铂和氟尿嘧啶(CF)治疗食管鳞癌(ESCC)患者的1b期临床试验初步结果
CS1001为PDL1抗体
1b期研究针对晚期食管鳞癌患者,且既往未接受过针对局部晚期或转移性疾病的系统性抗肿瘤治疗
18例晚期食管鳞癌患者接受CS1001联合CF化疗方案治疗后,其中14(77.8%)例患者达到了部分缓解(PR)。客观缓解率(ORR)可达到77.8%(14例),疾病控制率(DCR)高达88.9%
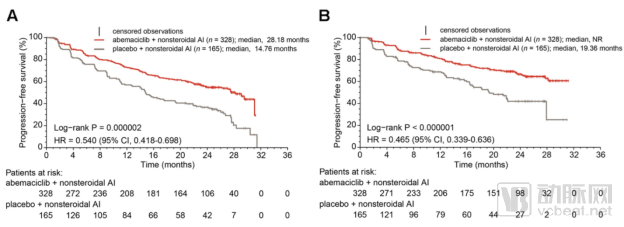
Abemaciclib联合芳香酶抑制剂在中国HR+/HER2-绝经后乳腺癌患者中显示出具有显著统计学意义的PFS的延长
礼来宣布在以中国患者为主的HR+/HER2-绝经后晚期乳腺癌女性中证实Abemaciclib联合芳香酶抑制剂显示出具有显著统计学意义的无进展生存期的延长
Abemaciclib为CDK4/6抑制剂
MONARCH plus是一项在以中国患者为主的HR+/HER2-绝经后晚期乳腺癌女性中进行的随机、双盲、3期临床研究
该研究达到了其主要研究终点,即abemaciclib联合芳香酶抑制剂(阿那曲唑或来曲唑)显示出具有显著统计学意义的无进展生存期的延长。其次内分泌治疗后疾病进展的女性患者接受abemaciclib联合氟维司群治疗的无进展生存期亦获得显著延长
Monarch研究公布PFS结果
数据来源:nature
❖罗氏宣布评估Perjeta与Herceptin固定剂量组合皮下注射制剂治疗HER2阳性早期乳腺癌的III期临床研究FeDeriCa达到主要终点:与标准的IV注射Perjeta与Herceptin联合化疗方案相比,疗效和安全性为非劣或类似
❖ 阿斯利康宣布,美国FDA授予其SGLT2抑制剂达格列净(dapagliflozin,商品名为Farxiga)快速通道资格,治疗心力衰竭成人患者
❖ 罗氏宣布,该公司开发的CD20抗体Gazyva获得FDA授予的突破性疗法认定,用于治疗狼疮性肾炎。这是罗氏公司获得的第27项突破性疗法
❖上海创诺提交的盐酸厄洛替尼片国内上市申请(CYHS1790011)获得国家药监局批准,成为该品种国内首仿厂家。该申请为注册分类6类,曾于2017年9月以“专利到期前1年的药品生产申请”被CDE纳入优先审评,属于国家鼓励开发的仿制药
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。