
# 热门搜索 #
君联医疗新药速递 第37期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
本周新药数据共7个,其中神经2个,血液2个,肿瘤2个,代谢1个
❖Allergan的CGRP小分子受体拮抗剂获批治疗偏头痛,这是这是FDA批准的第一款口服CGRP受体拮抗剂。CGRP通路是经典的偏头痛研发通路,MNCs在大分子和小分子赛道都尝试进行突破,此前小分子由于肝脏毒性导致研发进程一度中止,相反大分子有3款抗体药物获得FDA的批准,包括诺华和安进共同开发的Aimovig、梯瓦的Ajovy,以及礼来的Emgality,这些抗体由于半衰期很长,可以每月,甚至每三个月一次注射就能够有效减少患者的偏头痛的发作次数。Allergan的Ubrelvy是新一代的小分子CGRP受体拮抗剂,从目前看其结构有效地解决了肝脏毒性的问题,最终在小分子CGRP领域成功破冰。
❖ 韩美药业波奇替尼公布治疗NSCLC第一队列的临床数据,研究未能达到总响应率的预定主要终点,115名患者的总体响应率ORR仅14%,这直接导致合作伙伴Spectrum股价盘前暴跌50%。在NSCLC中,EXON 20插入突变的突变率在7%以上,但一直在无药可医的状态,即使是奥希替尼也束手无策,2018年WCLC波奇替尼公布针对该突变类型患者的ORR为43%,相当惊艳,虽然副作用比较大,但仍然让众人期待不已,没想到多中心的ORR出现断崖式的下跌。韩美此前与礼来、赛诺菲、BI、罗氏、强生、再鼎都有合作,授权产品开发,但几乎都以惨败告终,目前已被视为坑王。国内目前还有数家企业与韩美联合开发双特异抗体,未来得小心了。
Seattle Genetics HER2 TKI向FDA递交NDA
Seattle Genetics宣布已向FDA递交其HER2特异性口服TKI tucatinib的NDA,用于与曲妥珠单抗(trastuzumab)和卡培他滨(capecitabine)联用,治疗不可切除的局部晚期或转移性HER2阳性乳腺癌患者
Tucatinib是一种口服的酪氨酸激酶抑制剂,对HER2具有高选择性,但对同属人表皮生长因子受体家族的EGFR没有明显抑制作用
随机双盲含活性对照,旨在比较tucatinib联合标准治疗药物曲妥珠单抗和卡培他滨,与曲妥珠单抗和卡培他滨联用相比,在治疗局部晚期不可切除或转移性HER2阳性乳腺癌患者中的疗效与安全性
加入tucatinib的三联组合疗法显著提高患者的无进展生存期(PFS),与活性对照组相比,将患者的疾病进展或死亡风险降低46%。与对照组相比,三联疗法还改善了患者的总生存期(OS),将患者死亡风险降低了34%
韩美药业的波奇替尼在NSCLC的临床实验中,研究未能达到总响应率的预定主要终点
韩美药业和spectrum公布Poziotinib治疗NSCLC第一队列的临床数据,未达到临床终点,Spectrum股价盘前暴跌50%。韩美在国内的合作公司绿叶制药反馈,该项目的合作已终止。
波奇替尼主要用于治疗exon 20插入突变的NSCLC,该人群约占NSCLC人群的7%以上。
MD Anderson癌症中心开展了一项多中心II期试验,纳入了115名肿瘤患者。
115名患者的总体响应率ORR仅14%,疾病控制率68.7%,均远低于此前公布的数据(2018年WCLC公布ORR为43%,DCR为90%)。
Allergan CGRP受体拮抗剂获批治疗偏头痛
FDA宣布批准Allergan的降钙素基因相关肽(CGRP)受体拮抗剂Ubrelvy(ubrogepant)上市,用于急性治疗偏头痛,这是FDA批准的第一款口服CGRP受体拮抗剂
Ubrelvy是一款新一代小分子CGRP受体拮抗剂,三叉神经系统释放的CGRP是触发偏头痛发作的“开关”,它通过抑制CGRP受体从而发挥作用,其结构不同于上一代小分子拮抗剂,有效地解决了肝脏毒性的问题
共入组1439名偏头痛患者,进行随机双盲含安慰剂对照的临床试验,对其有效性和安全性进行评估
接受Ubrelvy治疗的患者在接受治疗后两小时内达到无痛和其它偏头痛主要症状消失的比例都显著优于安慰剂组
FibroGen低氧诱导因子脯氨酰羟化酶抑制剂递交NDA
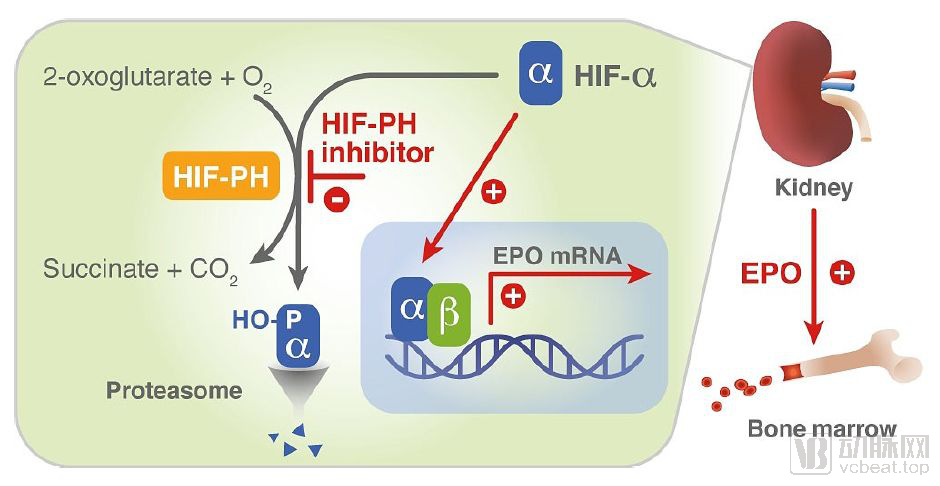
FibroGen宣布已经向FDA递交了该公司与安斯泰来和阿斯利康联合开发的低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)罗沙司他(roxadustat)的新药申请(NDA),治疗因慢性肾病而引起贫血的透析/非透析患者
Roxadustat是治疗肾性贫血的口服小分子低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),通过模拟脯氨酰羟化酶(PH)的底物之一酮戊二酸来抑制PH酶,影响PH酶在维持HIF生成和降解速率平衡方面的作用,从而达到纠正贫血的目的
3期临床,入组全球范围内1万多名患者,与标准疗法阿法依泊汀对比,评估有效性和安全性
与标准疗法阿法依泊汀相比,roxadustat对透析患者的临床获益和副作用没有显著差别。对于未接受透析治疗的肾性贫血患者而言,roxadustat可以使患者获得显著的临床疗效,有效纠正和维持肾性贫血患者血红蛋白水平
低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)作用机理
数据来源:Discovery of Molidustat
卫材食欲素受体拮抗剂Dayvigo获批上市
卫材食欲素受体拮抗剂Dayvigo获FDA批准上市,治疗失眠
Dayvigo(lembroexant)是一款食欲素(orexin)受体拮抗剂。食欲素是下丘脑分泌的一种神经肽,在维持觉醒中起到重要作用。同通过阻断食欲素A和食欲素B与食欲素受体1(OXR1)和食欲素受体2(OXR2)的相互结合,Dayvigo可以抑制觉醒,从而治疗失眠的多种症状
关键性3期研究,在总计约2000名成人失眠患者中评估了Dayvigo与对照药物和安慰剂相比的疗效
Dayvigo在主观和客观评价方面,均显示出与安慰剂相比,在入睡和睡眠维持方面的统计学显著性优势
BioMarin Pharmaceutical血友病基因疗法在美国递交上市申请
BioMarin Pharmaceutical公司宣布,已向美国FDA递交了其基因疗法valoctocogene roxaparvovec的生物制品许可申请(BLA),治疗A型血友病成年患者
Valoctocogene roxaparvovec是一种使用AAV5病毒载体递送表达因子VIII的转基因的基因疗法,该疗法已经获得美国FDA授予的突破性疗法认定和欧盟授予的PRIME药品认定,以及EMA和FDA授予的孤儿药资格
3期临床试验的中期数据分析,以及1/2期临床试验的最新3年疗效数据
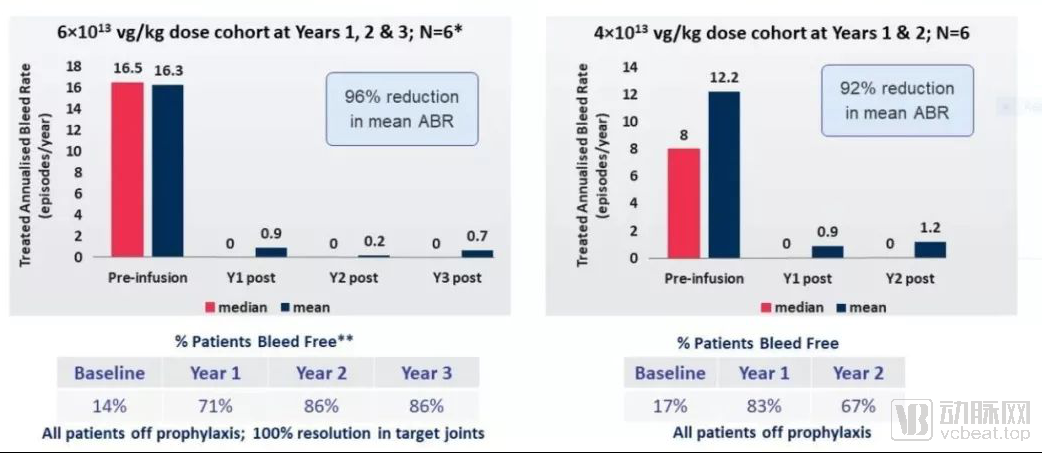
在1/2期临床试验中接受一次剂量为6e13 vg/kg的基因疗法治疗的患者,在接受治疗后第三年,年出血率(ABR)和使用因子VIII的需求继续得到控制。在接受治疗的3年过程中,ABR和因子VIII使用率都平均下降96%。患者不再需要预防性因子VIII注射
接受不同剂量基因疗法治疗的A型血友病患者ABR数据
数据来源:BioMarin
口服糖尿病疗法关键性3期试验数据积极,明年递交监管申请
Poxel SA与日本住友制药(Sumitomo Dainippon Pharma)公司联合宣布,其糖尿病创新疗法imeglimin,在治疗2型糖尿病患者的3期临床试验TIMES 2中,达到主要疗效终点
imeglimin是全球首款glimin类药物。它具有全新的作用机制。Poxel的科学家们认为,线粒体功能失调是糖尿病的原因之一,imeglimin通过改善线粒体的生物能学(mitochondrial bioenegetics),有望逆转这一疾病的潜在根源
旨在评估imeglimin作为单药疗法,或与目前已获批的多款降糖疗法联用(包括DPP-4抑制剂,SGLT2抑制剂,GLP-1受体激动剂,双胍类药物等等),治疗2型糖尿病患者的疗效与安全性
无论imeglimin作为单药疗法,还是与其它降糖疗法联合,都能使患者的糖化血红蛋白(HbA1c)水平得到显著降低
❖ Intra-Cellular Therapies公司宣布Caplyta(lumateperone)已经被美国FDA批准用于治疗成人精神分裂症。Caplyta是一种“first-in-class”强力血清素5-HT2A受体拮抗剂,同时它是多巴胺受体磷蛋白调节剂(DPPM)。Caplyta的疗效在两个含安慰剂对照的临床试验中得到证实,显示为在阳性和阴性症状量表(PANSS)总分上与安慰剂相比,有统计学意义的显著改善
❖Bridge Biotherapeutics公司宣布,该公司已经向美国FDA和韩国食品药品安全部(Ministry of Food and Drug Safety, MFDS)递交IND申请,申请启动检验BBT-176的1/2期临床研究。BBT-176是一款创新EGFR酪氨酸激酶抑制剂(TKI),它的设计旨在抑制携带C797S突变的EGFR
❖百济神州的PD-1抗体替雷利珠单抗的审批状态已变成”审批完成-待制证“状态,上市获批指日可待。当前我国已经批准了 6 家PD-1单抗,2 家进口,4 家国产。分别为百施美的Opdivo、默沙东的Keytruda、信达生物的达伯舒、恒瑞医药的卡瑞利珠单抗、君实生物的拓益和百济神州的替雷利珠单抗
❖我国原创治疗阿尔茨海默病新药九期一®(甘露特钠胶囊,代号:GV-971)终于正式在国内上市,单盒药物定价为895元人民币(规格:150mg*14粒*3板)。患者可凭医生处方,在全国各大专业药房(DTP药房)购买
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。