
2019年5月6日-2019年5月11日,本周新药数据共13个,其中罕见病7个,肿瘤3个,肺部疾病2个,血液病1个。
❖诺华和基因泰克在本周先后公布了脊髓性肌萎缩症(SMA)治疗药物Zolgensma(基因疗法)和Risdiplam的积极数据,试验结果显示不同类型的SMA患者未来有望获得更多的治疗选择。目前SMA仅有Biogen的Spinraza获批,2018年销量为17.24亿美金,未来Zolgensma和Risdiplam有望与其三分天下。
❖Opdivo治疗多形性胶质母细胞瘤(GBM)的3期临床研究失败,实验组的OS未得到显著改善。GBM目前的治疗药物主要为替莫唑胺和贝伐珠单抗,仍然存在巨大的未被满足的治疗需求。同时,O药在和K药的竞争中又丧失了一次机会,O药今年一季度的销售额为18亿美元,K药为23亿美元,由于K在肺癌领域已经站稳脚跟,预计未来K会持续压制O。
❖AZ的BTK抑制剂阿卡替尼针对复发难治的慢性淋巴细胞白血病(CLL)的3期达到临床终点。阿卡替尼是重磅药物依鲁替尼后第2个上市的BTK,2015年AZ通过40亿美元收购Acerta公司55%的股权获得阿卡替尼的权益。阿卡替尼在2017年11月切入套细胞淋巴瘤领域,现在终于切入CLL这个大赛道,作为标杆,依鲁替尼2018年的全球销售约为36亿美元。
诺华公布Zolgensma在广泛类型的
脊髓性肌萎缩症治疗中的积极结果
近日,诺华在美国神经学会AAN的年会上公布了Zolgensma在多种类型的脊髓型肌萎缩症SMA患者中的积极结果。
Zolgensma是一种基于腺相关病毒载体的基因疗法,可以将正常表达SMN蛋白的转基因通过AAV9病毒载体导入患者体内。
公布的3项临床试验数据中包括1项1期名为STRONG的开放标签、剂量比较、多中心的临床试验(针对大于6个月的SMA 2型患者),1项3期名为STR1VE的开放标签、单臂、单剂量、多中心试验(针对小于6个月的SMA 1型患者),1项3期名为SPR1NT的开放标签、单臂、多中心试验(针对具有2个或3个SMN 2基因拷贝、年龄≤6周的SMA患者)。
多种类型的SMA患者可以通过接受Zolgensma治疗降低死亡风险,提升运动能力。
AAV9 病毒载体结构
数据来源: Avexis官网
基因泰克公司宣布口服脊髓性肌肉萎缩症药物
Risdiplam在两项临床试验中取得积极结果
基因泰克公司公布了口服脊髓性肌肉萎缩症药物Risdiplam在两项临床试验中取得的试验结果,数据表明,Risdiplam可以用于治疗1型、2型和3型SMA患者。
Risdiplam是一款口服SMN2 RNA剪接调节剂,能通过调节SMN2 RNA的剪接过程,增加产生正常SMN蛋白的mRNA水平。
三期临床试验中,1型、2型和3型的SMA患者接受了治疗。
在17名接受治疗的SMA1型患者中,7名婴儿(41.2%)能够独立坐起5秒钟,9名婴儿(52.9%)能够保持头部正直,1名婴儿(5.9%)达到了站立的运动能力里程碑。2型和3型患者研究中,经过12个月的治疗,患者SMN蛋白表达水平平均提高一倍以上,58%的患者MFM32评分与基线相比提高了超过3%。
O药多形性胶质母细胞瘤三期临床试验失败
BMS宣布Opdivo在治疗多形性胶质母细胞瘤的III期临床研究CheckMate-498中未能达到延长总生存期的主要终点。
Opdivo是一款PD-1抑制剂。
CheckMate-498是一项3期、随机、多中心研究,阳性对照组接受替莫唑胺化疗和放射治疗。研究的主要终点是OS,次要终点包括无进展生存期(PFS)和两年总生存率。
与阳性对照组相比,实验组的OS未得到显著的改善。
Xencor靶向PD-1和ICOS的双抗药物
完成首例患者给药
Xencor宣布其在研双抗药物XmAb23104完成了1期临床试验的首例患者给药。
XmAb23104是一种同时靶向PD-1和ICOS(一种免疫共刺激受体)的双特异性抗体,能够促进肿瘤选择特异性T细胞的活化。
DUET-3是一项1期、多剂量、剂量递增临床研究,用于评估晚期实体瘤患者接受该药物治疗的安全性和耐受性。
临床试验进行中。
Xencor在肿瘤IO领域布局了多个双抗
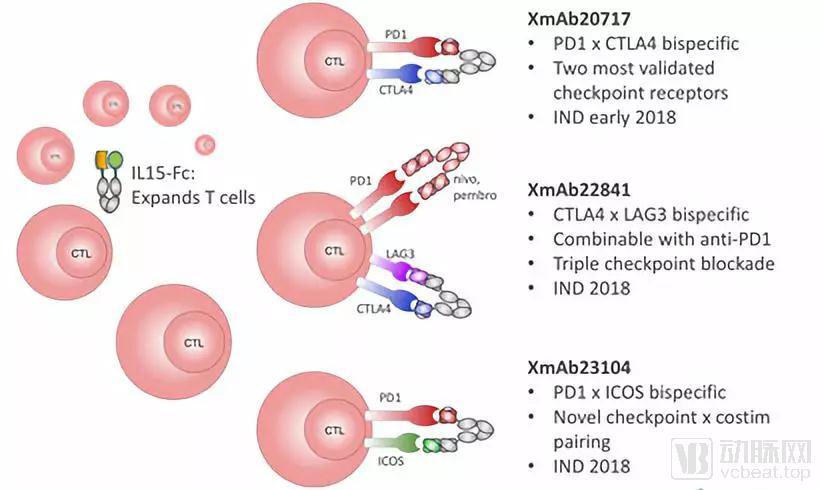
数据来源:Xencor官网
斯丹赛CAR-T项目ICTCAR014
在中国临床研究中前景积极
2019年美国基因与细胞治疗学会年会(ASGCT)上,研究人员报告斯丹赛公司的CAR-T项目ICTCAR014已经成功治疗了两名难治性弥漫性大B细胞淋巴瘤患者,前景积极。
ICTCAR014是装备有显性失活PD-1分子的抗CD19 CAR-T细胞。这些新型CAR-T细胞具备增强肿瘤杀伤能力,并且表现出更多记忆样表型。
两名患者已接收治疗,正在招募更多患者。
当患者被注入自体CAR-T细胞后,肿瘤明显缩小,SUV max值在PET/CT结果和持续响应中下降(从34.48下降到3.89;从25.02下降到2.38)。
全球首个治疗FCS的反义寡核苷酸药物
Waylivra获得欧盟上市许可
Ionis Pharmaceuticals及其子公司Akcea Therapeutics宣布,两家公司共同开发的反义寡核苷酸药物Waylivra(volanesorsen)已获得欧盟的有条件上市许可,用于家族性乳糜微粒血症综合征(FCS)成年患者的辅助治疗。这是全球首个获批的FCS治疗药物。
Waylivra是一种反义核苷酸药物,能减少影响代谢的ApoC-III蛋白质的产生。
批准基于基于3期临床APPROACH研究、3期临床COMPASS研究和正在进行的APPROACH开放标签扩展研究成果。
较之安慰剂组,使用Waylivra治疗可以使患者的甘油三酯水平降低94%。
Viela Bio抗CD19单抗
在3期临床试验中达到终点
Viela Bio公司宣布其在研抗CD19单克隆抗体inebilizumab,在治疗视神经脊髓炎谱系疾病的3期临床试验中达到主要终点和关键性次要终点。Inebilizumab预计将在年中提交BLA。
Inebiilizumab是靶向CD19的高亲和力人源单抗,能有效结合B细胞表面CD19抗原并清除产生自身抗体的细胞。
名为N-Momentum的临床试验,共有231名患者入组。
Inebilizumab达到了试验的主要终点,与安慰剂组相比将抗AQP4抗体阳性患者中的发病风险降低了77%,将总患者群的发病风险降低了73%。
阿斯利康BTK抑制剂达到3期临床终点
阿斯利康的新型布鲁顿氏酪氨酸激酶(BTK)抑制剂Calquence(acalabrutinib),在治疗复发/难治性慢性淋巴性白血病患者的3期临床试验中达到主要终点。
Calquence是阿斯利康开发的一款新型BTK抑制剂。
310名曾经接受过前期治疗的CLL患者被分为两组,分别接受Calquence单药治疗,或者rituximab加idelalisib或bendamustine的组合疗法。
实验组的患者得到了统计显著的PFS改善。
FDA 批准辉瑞治疗心肌疾病新药上市
辉瑞公司宣旗下药物Vyndaqel(tafamidis meglumine)和Vyndamax(tafamidis)获FDA批准上市,用于治疗野生型或遗传性转甲状腺素蛋白介导的淀粉样变性引起的心肌病(ATTR-CM)。这也是获FDA批准的首款ATTR-CM疗法。
两种获批药物是转甲状腺素蛋白稳定剂tafamidis的两种口服配方。
批准基于名为ATTR-ACT的关键性3期、随机双盲、含安慰剂对照的全球性临床试验。
试验结果表明,Vyndaqel将全因死亡风险降低了30%,将心血管相关住院风险降低了32%,同时提高了患者的其它功能性指标。
默沙东宣布其15价肺炎球菌结合疫苗
达到2期临床终点
默沙东宣布其在研15价肺炎球菌结合疫苗V114在2期临床试验中达到主要终点。
V114疫苗是一款新型15价肺炎球菌多糖结合疫苗,能令接种儿童对15种常见的导致肺炎球菌性疾病的血清型病菌产生免疫反应。
名为V114-008的随机双盲2期临床试验,共有1050名健康婴儿接受接种。
试验结果显示,相较13价肺炎疫苗PCV13,V114的免疫反应效果达到非劣效性。对于两种新纳入的血清型22F和33F,V114组中达到免疫反应标准的患者比例分别超过98%和87%。
阿斯利康慢性阻塞性肺疾病
维持性治疗新药获批上市
阿斯利康与Circassia制药共同开发的慢性阻塞性肺疾病药物Duaklir近日获FDA批准上市。
Duaklir是长效毒蕈碱拮抗剂溴化丙啶和长效β-激动剂富马酸福莫特罗的固定剂量组合。
本次批准基于三项3期临床研究(ACLIFORM,AUGMENT及AMPLIFY)以及临床4期ASCENT研究结果。
接受治疗的慢性阻塞性肺病患者病情恶化程度明显减轻。
BioMarin酶替代疗法
获欧盟批准治疗苯丙酮尿症
BioMarin Pharmaceutical公司宣布,该公司开发的Palynziq(pegvaliase injection)获欧盟批准上市,用于治疗16岁以上苯丙酮尿症患者。
Palynziq是一种聚乙二醇化的苯丙氨酸氨解氨酶。
批准基于名为PRISM-2的36个月3期临床试验结果。
试验数据表明,接受治疗的患者苯丙氨酸水平平均从从基线的1233 µmol/L降低到565 µmol/L(12个月,n=164),345 µmol/L(24个月,n=90)和341 µmol/L(36个月,n=48)。
首款Lambert-Eaton肌无力综合征
儿科患者用药获批上市
近日,FDA批准了Jacobus Pharmaceutical公司研发的Ruzurgi(amifampridine)上市。Ruzurgi用于治疗6-17岁的Lambert-Eaton肌无力综合征(LEMS)患者。这也是获FDA批准的第一款儿科LEMS药物。
Ruzurgi的活性成分是3,4-二氨基吡啶。
本次批准基于LEMS患者临床试验数据和根据药代动力学模型模拟出的儿童患者剂量和儿童患者中的安全性数据。
试验数据显示,接受Ruzugi治疗的患者运动能力下降的速度慢于安慰剂组。

❖诺华宣布以53亿美金(34亿前期付款+19亿里程碑付款)收购武田/Shire的干眼症药物Xiidra。Xiidra2016年获FDA批准上市,2018年全球销量3.87亿美金。此前诺华剥离了爱尔康,但仍然保留了眼科药物研发部门。
❖Spectrum Pharmaceuticals宣布与ImmunGene达成资产购买和授权许可协议,将以300万预付款及1.56亿美金里程碑付款获得后者包括UCLA科学家最初开发的FIT抗体-干扰素融合技术药物传递平台相关IP的独家授权和两个诞生自该平台的产品。
❖辉瑞宣布以3.4亿美金预付款加潜在的4.7亿美金追加里程碑付款收购专注于开发罕见病创新疗法的临床期生物技术公司Therachon。Therachon公司的主打在研药物TA-46是一款治疗软骨发育不全的first-in-class生物制剂。
❖Mustang Bio 宣布招募首个靶向CS1蛋白(或称CD319/CRACC/SLAMF7)的CAR-T多发性骨髓瘤临床试验MB-104的患者。团队认为CS1蛋白是一个很有希望的靶点,能够带领公司在BCMA靶点的拥挤竞争中开辟新的道路。
❖Shattuck Labs宣布启动其双特异性抗体候选药物SL-2792521期剂量递增和扩展临床试验,该药物能够同时阻断PD-L1抑制信号并激活OX40信号传导。目前武田已经获得SL-2792521的开发和商业化权益。
❖和铂与正大天晴药业宣布双方已正式签署产品开发战略合作协议,将在肿瘤免疫及免疫性疾病领域开展创新型抗体药物的开发及商业化合作。双方将结合和铂拥有的全人源转基因小鼠平台与正大天晴临床前药物开发的丰富资源共同推动创新全人源抗体药物的发现。
❖吉利德科学和Goldfinch Bio公司达成研发合作,共同发现、开发和推广治疗糖尿病肾病和其它罕见肾病的创新疗法。Goldfinch公司将获得5500万美金前期付款,5400万美金平台建设资金和潜在的19.5亿美金里程碑付款。
❖Skyhawk Therapeutics公司与武田公司达成研发合作协议,该公司靶向RNA的SkySTAR技术平台在今后将帮助武田公司研发特定神经疾病的创新小分子疗法。
❖Amgen公司宣布与精准医疗公司Syapse达成合作,通过真实世界数据支持癌症药物研发。Syapse公司是一家整合碎片化的临床、分子、治疗和健康后果数据以帮助实现精准医疗的生物技术公司,公司数据共享网络汇集了来自多个医院系统的真实世界医疗信息。
❖药明康德宣布达成对美国临床研究服务公司Pharmapace的收购。Pharmapace公司能够为临床试验各阶段、注册申报及上市后支持提供高质量的数据统计分析服务。收购完成后,Pharmapace将成为药明康德旗下临床CRO公司康德弘翼的全资子公司。

































