
2019.7.1-2019.7.7,本周新药数据共11个,其中肿瘤3个,基因治疗等创新疗法3个,感染2个,眼科、肌肉和血液疾病各1个。
❖Sangamo Therapeutics和辉瑞公布A型血友病基因疗法SB-525在1/2期临床试验的积极结果。对于辉瑞这样的传统医药巨头,若想实现巨象跳舞,借鸡生蛋可能是必不可少的操作。2017年5月,辉瑞支付Sangamo 7000万美元的预付款,开发和商业化多个基因疗法项目,后者还有资格获得4.75亿美元的里程碑付款。另外2014年,辉瑞就与另一家基因治疗公司Spark Therapeutics达成了战略合作,开发B型血液病的基因疗法SPK-9001。
❖Karyopharm的selinexor终于获批在美国上市,该药目前用于多发性骨髓瘤的5线治疗。由于MM目前疗法众多,Selinexor若想在商业上有所突破,还需要努力提升药物的治疗优先级,以及拓展其他适应症。目前selinexor+地塞米松+硼替佐米计划做MM的三线治疗,同时拓展DLBCL的适应症。
❖罗氏公司宣布MINISTONE-2临床试验达到主要终点,表明Xofluza与达菲相当,对流感患儿有良好的耐受性。随着达菲专利到期,罗氏一直试图寻找更优秀的下一任。不过罗氏这次没有发布太多xofluza试验的实际数据,只是说它符合主要终点,其是否能成功取代前任还需要看后续的详细数据。
Array BioPharma公布三联疗法治疗BRAF V600E
突变的转移性结直肠癌(mCRC)患者
3期临床试验结果
Array BioPharma公布了该公司开发的三联疗法在治疗携带BRAF V600E突变的转移性结直肠癌(mCRC)患者的3期临床试验结果,公司计划今年年底提交NDA申请。
三联疗法由BRAF抑制剂Braftovi(encorafenib)、MEK抑制剂Mektovi(binimetinib)、和抗EGFR抗体Erbitux(cetuximab)构成。
在全球性3期临床试验中,携带BRAF V600E的mCRC患者分为三组,分别接受三联疗法,Braftovi和Mektovi双联疗法,或化疗治疗。这些患者已经接受过一种或两种前期治疗,并且疾病继续进展。
三联疗法与标准化疗相比,显著提高患者的OS(9个月vs5.4个月,HR=0.52),ORR(26.1% vs 1.9%),和中位PFS(4.3个月vs 1.5个月,HR=0.38)。
Sangamo Therapeutics和辉瑞公布A型血友病
基因疗法SB-525 1/2期临床试验结果
Sangamo Therapeutics公司和辉瑞公司公布了双方联合开发的A型血友病基因疗法SB-525在1/2期临床试验中获得的最新结果。
SB-525是一款使用AAV6病毒载体携带表达人类凝血因子VIII的转基因的基因疗法,这一疗法的病毒载体设计旨在优化病毒载体的成产效率和肝脏特异性凝血因子VIII蛋白的表达。
在这项1/2期临床试验中,10名患者接受了递增剂量SB-525的治疗,其中4名患者接受了3e13 vg/kg的最高剂量。
在4名接受最高剂量治疗患者中,2名患者的因子VIII水平已经达到正常区域,另外2名患者的因子VIII上升速度与前2名患者相当。而且,所有接受最高剂量SB-525治疗的患者在接受治疗后没有出现出血事件,并且在最初使用预防性因子VIII之后不再需要因子VIII替代疗法。
SB-525的实验结果
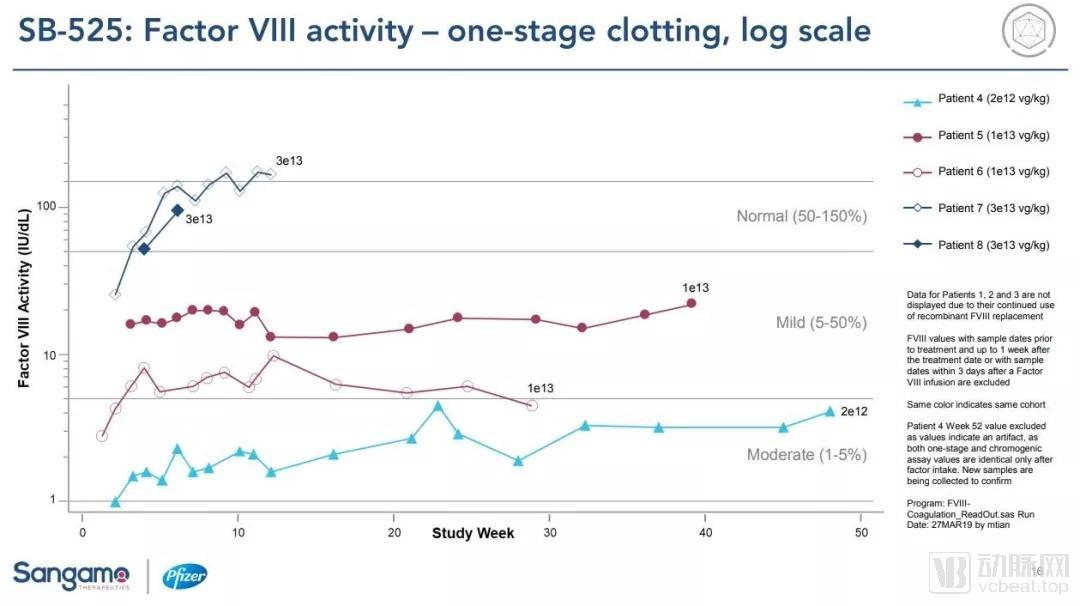
数据来源:pfizer
Tyme Technologies在研药物组合SM-88
在治疗晚期胰腺癌患者的实验中
显著延长患者的总生存期(OS)
Tyme Technologies公司宣布,其在研药物组合SM-88,作为单药疗法,在治疗晚期胰腺癌患者实验中,与历史数据相比,显著延长患者的总生存期(OS),并展示了良好的耐受性和安全性。
SM-88是Tyme开发的独创药物组合,它由酪氨酸衍生物和其它3种药物(rapamycin,phenytoin和methoxsalen)构成。SM-88能够只靶向活跃的肿瘤细胞,从而避免很多化疗药物的毒副作用。
试验包括49名接受过高强度放疗的转移性胰腺癌患者,其中超过80%的患者至少接受过两种治疗。
在这一预后不良的人群中,截至2019年4月25日,SM-88的中位OS为6.4个月,而在过去19项前瞻性胰腺癌试验的分析中,癌症进展后三线治疗的中位生存期仅为2.0-2.5个月。
Bicycle Therapeutics宣布治疗糖尿病黄斑水肿的
在研疗法THR-149在1期临床试验中获得积极结果
Bicycle Therapeutics公司宣布,治疗糖尿病黄斑水肿(Diabetic Macular Edema,DME)的在研疗法THR-149在合作伙伴Oxurion开展的1期临床试验中获得积极结果。
THR-149是一款基于双环多肽的创新血浆激肽释放酶(plasma kallikrein,PKal)抑制剂。
在一项开放标签,非随机1期临床试验中,12名中央视觉受损的DME患者通过玻璃体内注射接受了一次THR-149的治疗。
在接受治疗第一天后,患者的视力就得到了迅速改善,在接受治疗后第14天,患者的BCVA平均提高7.5个字母。在接受注射90天后,BCVA平均提高6.5个字母。
Karyopharm Therapeutics公司开发的Xpovio(selinexor)被批准上市
治疗复发/难治性多发性骨髓瘤患者
FDA宣布,加速批准Karyopharm Therapeutics公司开发的Xpovio(selinexor)上市,与地塞米松(dexamethasone)联用,治疗复发/难治性多发性骨髓瘤患者。
Xpovio是一种口服的选择性核输出抑制剂,与核输出蛋白(nuclear export protein)XPO1结合并且抑制它的功能。
Xpovio与地塞米松联用,末线治疗83名复发/难治性多发性骨髓瘤患者。
在这些高度难治的患者中,组合疗法达到25.3%的总缓解率,缓解持续时间为3.8个月。
Genentech的创新流感疗法Xofluza
在全球性3期临床试验中达到主要终点
罗氏旗下基因泰克公司(Genentech)宣布,该公司的创新流感疗法Xofluza(baloxavir marboxil)在名为MINISTONE-2的全球性3期临床试验中达到主要终点。
Xofluza的作用机制与目前已有抗病毒疗法不同,它通过抑制流感病毒中的cap-依赖型核酸内切酶(cap-dependent endonuclease)起到抑制病毒复制的作用。
在两项总计包含1832名流感患者的3期临床试验中,患者接受了Xofluza,安慰剂或另一抗流感药物的治疗。
在治疗1-12岁儿童流感患者时表现出良好的安全性,同时显著缩短流感症状(包括发烧)。
Xofluza作用机制
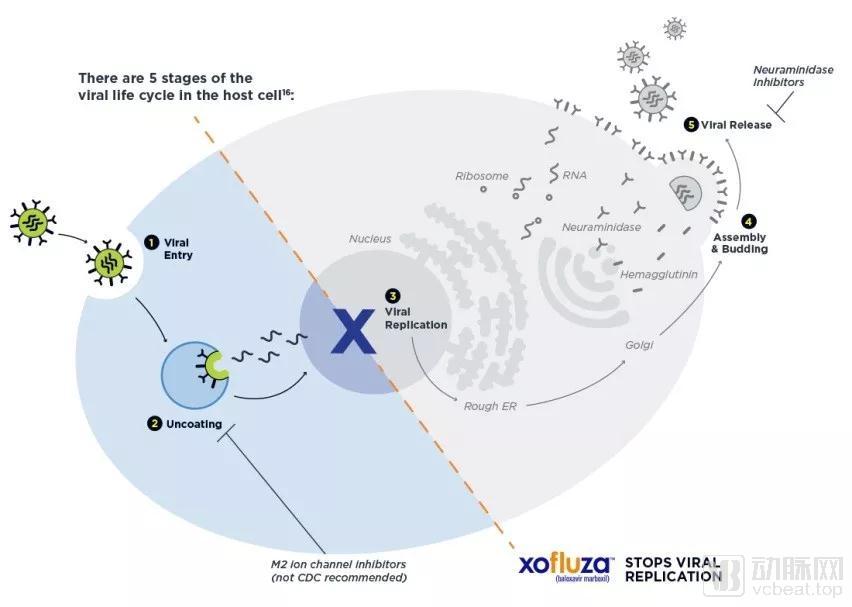
数据来源:genentech
Biogen公布了反义寡核苷酸(ASO)疗法
Spinraza在SMA婴儿患者中的长期疗效结果
。Biogen公布了该公司治疗脊髓性肌肉萎缩症(SMA)的反义寡核苷酸(ASO)疗法Spinraza,在SMA婴儿未出现症状前开始治疗的长期疗效结果。
Spinraza是一种反义寡核苷酸药物,它通过改变SMN2基因信使RNA前体(pre-mRNA)的剪接,增加具有正常功能的运动神经元生存蛋白的生产。
在开放标签2期临床试验NURTURE中,25名SMA患者在出生6周内就接受Spinraza治疗,这时他们还未表现出疾病症状。
100%的患者可以自主呼吸;100%的患者可以不经协助,独立坐起来;88%的患儿可以独立行走;同时Spinraza展示出近4年的长期有效性。
FibroGen公司公布pamerevlumab
在治疗非卧床DMD患者的2期临床试验的中期结果
FibroGen公司公布了治疗杜兴氏肌营养不良症(DMD)的在研药物pamerevlumab,在治疗非卧床(non-ambulatory)DMD患者的2期临床试验的中期结果。
pamrevlumab是一款CTGF全人源化单克隆抗体。CTGF是纤维化和增生障碍中常见的因子,这类疾病的特征是持续和过度瘢痕组织的产生导致器官功能异常和衰竭。
单臂2期临床试验中,总计21名DMD患者接受了pamrevlumab的治疗。
接受治疗52周之后,在意向治疗患者群(ITT)中,患者的平均LVEF%与基线相比上升了0.29%。在基线LVEF%大于50%的患者亚群中,pamrevlumab的治疗导致这一指数平均上升了1.79%。
Pfizer公布治疗杜兴氏肌营养不良症
的基因疗法在1b期临床试验中获得初步结果
辉瑞(Pfizer)公司公布了旨在治疗杜兴氏肌营养不良症(Duchenne muscular dystrophy, DMD)的基因疗法PF-06939926,在1b期临床试验中获得的初步结果。
PF-06939926是一款在研基因疗法,它将由人类肌肉特异性启动子控制的“迷你”抗肌萎缩蛋白(mini-dystrophin)转基因装在腺相关病毒9(AAV9)载体中。
在这项1b期临床试验中,6名6-12岁患者接受了一次剂量为1E14 vg/kg(低剂量)或3E14 vg/kg(高剂量)的PF-06939926的治疗。
在接受治疗2个月之后,接受低剂量疗法治疗的患者,肱二头肌样本中表达迷你抗肌萎缩蛋白的肌纤维比例为38%,接受高剂量疗法治疗的患者这一数值为69%。
FDA接受RedHill Biopharma创新幽门螺杆菌清除疗法
Talicia的新药申请(NDA)并授予优先审评资格
专注于胃肠道疾病的生物医药公司RedHill Biopharma宣布,FDA接受了其创新幽门螺杆菌清除疗法Talicia的新药申请(NDA),并且授予其优先审评资格。
Talicia(RHB-105)是一款新型的固定剂量口服胶囊,其配方包含2种抗生素:rifabutin(利福布汀)和amoxicillin(阿莫西林),以及1种质子泵抑制剂(PPI)omeprazole(奥美拉唑)。
ITT患者,随机双盲对照,实验组服用Talicia,对照组使用标准疗法。
Talicia组84%患者的幽门螺杆菌感染得到清除,而对照组仅为58%,数据具有高度统计学显著差异(p<0.0001),达到了试验的主要终点。
FDA批准DOVE Pharmaceuticals
血小板生成素受体激动剂
治疗慢性免疫性血小板减少症(ITP)成人患者
DOVE Pharmaceuticals公司宣布,FDA批准该公司的血小板生成素受体激动剂Doptelet (avatrombopag)扩展适应症,治疗慢性免疫性血小板减少症(ITP)成人患者。
Doptelet(avatrombopag)是一种与食物一起服用的口服TPO-RA,能模拟TPO的作用,TPO是正常血小板生产的主要调节因子。
在关键性3期临床研究中,与安慰剂进行对照。
Doptelet给药导致大多数患者在治疗的第八天血小板计数至少为50,000 /μL,在为期6个月的疗程中,Doptelet维持血小板计数在目标范围内的效果优于安慰剂。

❖强生旗下杨森制药公司宣布终止与韩美在GLP-1/GCG双受体激动剂降糖药JNJ-6456511(HM12525A)上的合作,退还全球开发权益。受此消息刺激,韩美股价在当天暴跌27%。
❖GSK在中国提交的注射用贝利尤单抗上市申请获得国家药品监督管理局(NMPA)批准,意味着这款创新性的SLE新药不久后就可在中国上市, 贝利尤单抗可以说是60年来的首个红斑狼疮新药。
❖康方生物宣布其自主研发的PD-1/VEGF双特异抗体新药AK112获得美国 FDA颁发的药物临床试验(IND)批件。
❖亿腾药业(EOC Pharma)宣布其已与盐野义制药(Shionogi)就化合物Epertinib达成了区域性授权许可协议。Epertinib是一种用于治疗乳腺癌脑转移的HER2/EGFR抑制剂。
❖NMPA有条件批准达雷妥尤单抗注射液进口注册申请,用于单药治疗复发和难治性多发性骨髓瘤成年患者,包括既往接受过一种蛋白酶体抑制剂和一种免疫调节剂且最后一次治疗时出现疾病进展的患者。
❖致力于开发治疗遗传疾病创新疗法的BridgeBio Pharma公司正式登陆纳斯达克,通过IPO融资高达3.48亿美元,是今年最大生物技术IPO。BridgeBio拥有多个研发项目,每个研发项目由半自主的分公司进行,目前该公司的研发管线中有16个研发项目,其中3个已经处于3期临床试验阶段。
❖正大天晴宣布,安罗替尼取得治疗软组织肉瘤的药品注册批件,用于腺泡状软组织肉瘤、透明细胞肉瘤等,这是继晚期非小细胞肺癌后,安罗替尼获批的第二个适应症,安罗替尼也因此成为中国首个获批的软组织肉瘤靶向药。

































