
# 热门搜索 #
君联医疗全球新药资讯速递 · 第28期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
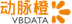 提供支持
提供支持
本周新药数据共9个,其中肿瘤4个,神经1个,呼吸1个,心血管1个,消化1个,血液1个。
❖ Biogen治疗阿尔茨海默病的在研疗法aducanumab在今年三月终止实验后,宣告复活,预计明年向FDA递交BLA申请,受此消息刺激,biogen的股价飙升40%,对于$40B市值的企业,这种股价波动非常罕见。AD这个领域此前一直被视为被诅咒的土地,埋葬了无数新药的梦想,在这个赛道下注的企业很多都是怀着go big的梦想但只能接受 go home的结果。不过虽然Aducanumab这次卷土重来声势浩大,但不少人也质疑现有结果更多是数据分析的胜利,而不是药效的重大突破,未来审批的前景仍不明朗。但aducanumab只要获批,预计就会加冕新一代药王。
❖ 罗氏宣布Tecentriq(阿特珠单抗)联合Avastin(贝伐珠单抗)治疗既往肝细胞癌患者的3期临床研究达到了两个终点,T+A方案在OS和PFS方面相比索拉非尼有明显提升,这是索拉非尼后首个一线能够提升肝癌OS数据的方案,堪称历史里程碑事件(是的,乐伐替尼也仅是达到OS非劣)。肝癌治疗此前一直被索拉非尼垄断,虽然疗效欠佳,但众多挑战者都在头对头实验中被斩于马下。这几年终于有柳暗花明趋势,乐伐替尼上位一线不久后,K+乐伐的combo便将ORR提升到45%左右,现在T+A更是获得OS的显著获益。未来新药若想在肝癌领域有所作为,仅仅将索拉非尼作为竞争对手已经是不够了。
Biogen宣布2020年初提交阿尔茨海默病新药上市申请
Biogen和日本卫材宣布在与FDA协商后,计划将在2020年初向FDA提交阿尔茨海默病药物aducanumab的生物制品许可上市申请,并将继续与欧洲、日本等地区的监管机构进行协商
aducanumab是Biogen和与日本药企卫材(Eisai)公司合作开发的生物蛋白疗法,靶向β淀粉样蛋白,这是一种在大脑中形成块状斑的蛋白质,被认为是导致这种疾病的原因
对III期临床研究中较大的数据集进行分析,包括3285例患者,其中2066例患者有机会完成整个18个月的治疗
认为研究达到了其主要终点,患者临床认知衰退显著减少;接受高剂量的患者亚群的分析结果也支持了其研究结果。接受aducanumab治疗的患者在认知和功能指标如记忆、定向和语言方面显著获益
Aducanumab作用机制
数据来源:creative biolabs
阿斯利康达格列净获批新适应症用于降低心衰风险
阿斯利康宣布FDA已批准达格列净用于降低患有2型糖尿病和其他心血管疾病风险的成年人因心力衰竭而住院的风险,目前正在中国进行监管审查,预计于2020年上半年作出决定
达格列净是口服SGLT2抑制剂,SGLT2是肾脏内协助葡萄糖重吸收的转运蛋白。达格列净通过抑制SGLT2的功能,让更多葡萄糖从尿液中排走,从而降低血液中的葡萄糖水平
随机双盲安慰剂对照的多中心3期研究,评估达格列净与安慰剂相比,对具有心血管事件风险的成年2型糖尿病患者在心血管结局上的效果
达格列净与安慰剂相比,心力衰竭或心血管死亡这一主要复合终点的风险显著降低了17%,心力衰竭风险显著降低了27%,各患者亚组的治疗获益均一致
Alexion长效C5补体抑制剂Ultromiris获批用于治疗非典型溶血尿毒综合征
Alexion 宣布FDA批准Ultromiris用于治疗非典型溶血尿毒综合征患者(年龄一个月以上)的补体介导血栓性微血管病,这是Ultomiris首次获批用于治疗儿科患者
Ultomiris是一种长效C5补体抑制剂,它通过抑制补体级联通路的效应蛋白C5来抑制补体信号通路的激活,患者只需每8周接受一次注射就可以有效抑制补体信号通路的激活
基于两项全球性,单臂开放标签研究的结果,其中包括一项成人临床试验和一项儿科患者临床试验
在最初为期26周的疗程后,54%的成人患者和71%的儿童患者出现血栓性微血管病(TAM)的完全缓解
杨森Stelar获FDA批准溃疡性肠炎新适应症
杨森公司宣布FDA批准Stelara(乌司奴单抗)用于治疗成人中重度活动性溃疡性肠炎
Stelara是IL-12/IL-23生物制剂靶向疗法,是首个获批用于治疗溃疡性肠炎、以内窥镜检查评估黏膜改善的终点指标评估后发现对小肠内壁具有改善作用的治疗药物
包括两个阶段,诱导期患者接受一次静脉注射Stelara 6mg/kg,8周之后进入维持期,患者接受皮下注射Stelara 90mg,每8周一次,为期44周
诱导治疗阶段,受试组19%患者在8周后实现临床缓解,其中58%患者同时实现了症状缓解。维持治疗阶段,45%患者在治疗1年后实现临床缓解,其中有43%不再需要使用糖皮质激素药物
罗氏T+A免疫联合疗法达到OS终点
罗氏官网首曝Tecentriq(阿特珠单抗)联合Avastin(贝伐珠单抗)治疗既往未接受过系统治疗的不可切除的肝细胞癌(HCC)患者的3期临床研究IMbrave150达到了两个主要终点
Secuado是非典型抗精神病药物asenapine的透皮皮贴剂疗法。Noven公司开发的透皮给药系统(TDDS)可以在给药的24小时内维持血液中的药物浓度。
纳入501例未接受过全身治疗的不可切除HCC患者,以2∶1的比例随机分配接受Tecentriq+Avastin联合治疗或目前的肝癌标准疗法索拉非尼治疗。共同主要终点OS、IRF、PFS,次要终点包括ORR、TTP和DOR,以及 PRO、安全性和药代动力学
达到了两个主要终点,证明与标准治疗索拉非尼相比,T+A方案在总生存期(OS)和无进展生存期(PFS)方面都达到了具有统计学意义和临床意义的提升
诺华哮喘新药fevipiprant 3期临床失败
诺华宣布旗下哮喘缓解剂fevipiprant在两项3期临床(ZEAL 1和ZEAL 2)中,与安慰剂相比,fevipiprant均未能改善患者肺功能
Fevipiprant是一款DP2拮抗剂,DP2是参与驱动过敏性哮喘炎症过程的受体,该类哮喘药物能够治疗极少数不受控制形式的哮喘患者
招募了约700名病情未能有效控制的哮喘患者,随机将他们分组接受除标准治疗外的每日一次fevipiprant或安慰剂治疗,主要终点是12周后患者肺功能FEV1的变化
与安慰剂相比,fevipiprant均未能改善患者肺功能。至于该药物有没有在试验中达到次要终点,诺华并没有做出说明,包括跟踪患者白天哮喘症状评分和生活质量在内的指标
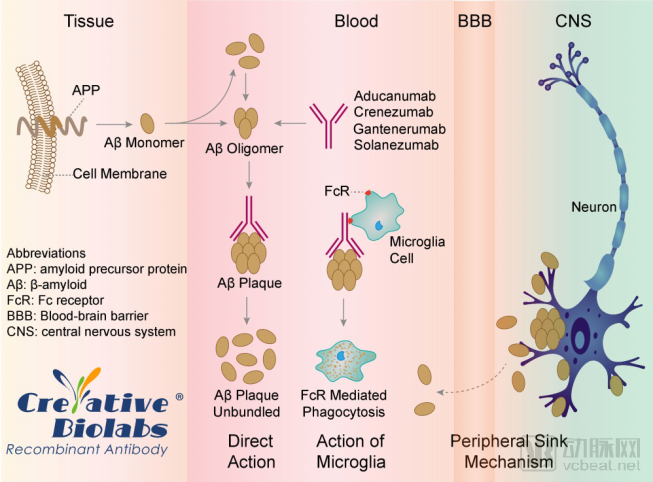
Arvinas的PROTAC疗法1期临床耐受性出色
Arvinas公布了其PROTAC疗法的最新数据。在两项1期临床试验中,其领先疗法ARV-110和ARV-471均取得了良好的耐受结果
PROTAC疗法是一种蛋白降解技术,它使用小分子药物,一头靶向目标蛋白,另一头让E3连接酶与目标蛋白接触,促进后者的降解
ARV-110的1期临床实验旨在通过PSA水平和RECIST标准,来了解ARV-110的潜在生化活性和临床活性;ARV-471的临床试验除评估安全性和药代动力学数据外,旨在研究雌激素的降解情况等指标
在3个剂量爬升组(35 mg,3名患者;70 mg,4名患者;140 mg,3名患者)中,该疗法的耐受良好,没有限制剂量的毒性反应,也没有观察到2级、3级、或4级的相关副作用
PROTAC双特异性分子作用机制
数据来源:Arvinas
Syros制药AML创新疗法2期临床结果积极
Syros制药宣布其选择性视黄酸受体α(RARa)激动剂SY-1425,与低甲基化剂azacitidine联合,在治疗新确诊的AML患者的2期临床试验中获得积极试验数据
SY-1425是一种“first-in-class”的选择性口服视黄酸受体α激动剂,它可以驱动促进细胞分化的基因的表达
40名不适合接受标准化疗的AML患者接受了SY-1425与azacitidine的联合治疗,中位年龄为76岁,包含13名RARA阳性患者和4名IRF8阳性患者
在RARA阳性患者群中,完全缓解和完全缓解兼部分血细胞计数缓解的患者比例为62%,完全缓解的患者比例为54%,缓解持续时间(DOR)最高达到344天,82%的患者实现或维持对不依赖输血的状态
GSK尼拉帕利获批用于治疗同源重组缺陷卵巢癌患者
FDA宣布批准GSK的尼拉帕利扩展适应症,用于治疗接受过3种以上化疗的晚期卵巢癌患者,这些患者的肿瘤为同源重组缺陷(HRD)阳性
PARP抑制剂通过抑制PARP介导的DNA损伤修复机制,在携带BRCA基因突变的肿瘤中导致过度DNA损伤的积累,从而引发细胞死亡
全球多中心、开放、单臂研究,共入组463位既往至少接受过3线或以上化疗的晚期复发性卵巢癌患者,均采用尼拉帕利治疗
尼拉帕利不但在携带BRCA基因突变的患者中产生疗效(总缓解率为29%),在不携带BRCA基因突变,但是具备同源重组缺陷的患者中也产生了疗效(总缓解率为15%)
❖ 强生旗下杨森医药公司爱可泰隆日前公布了OPTIMA研究的数据。OPTIMA研究的结果证实了Opsumit与他达拉非组成的初始口服双联疗法对PAH患者的疗效和安全性,并补充了支持联合治疗作为标准护理的证据
❖Trovagene公司宣布在研PLK1抑制剂onvansertib,与Folfiri,Avastin(bevacizumab)联合,作为二线疗法在治疗携带KRAS基因突变的转移性结直肠癌患者的1b/2期临床试验中,取得积极的试验初期数据
❖ Sigrid Therapeutics公司宣布,该公司开发的突破性疗法SiPore15在名为STAR的临床试验中获得积极结果。在糖尿病前期和新确诊的2型糖尿病患者中,SiPore15能够显著降低糖化血红蛋白水平
❖ Seattle Genetics公司宣布,其HER特异性口服小分子酪氨酸激酶抑制剂tucatinib,在治疗局部晚期或转移性HER2阳性乳腺癌患者的关键性3期试验HER2CLIMB中,达到试验的主要和关键性次要终点。Seattle Genetics公司计划于2020年第一季度向美国FDA递交新药申请
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。