
# 热门搜索 #
君联医疗全球新药资讯速递 · 第18期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
2019.8.12-2019.8.18,本周新药数据共10个,其中肿瘤5个,血液、代谢、CNS、感染和免疫各1个。
❖新基的Inrebic和艾伯维的Rinvoq同日宣布上市,这代表JAK蛋白激酶家族具有选择性的第二代JAK抑制剂正式登场。第一代JAK抑制剂主要为Pan-JAK,有4个产品,对多个JAK靶点都能产生抑制效果,但会产生感染、贫血、中性粒细胞减少症等并发症。第二代JAK抑制剂的开发旨在提高抑制剂的选择性,目前除了Inrebic和Rinvoq以外,吉利德的JAK1抑制剂filgotinib预计将在今年递交NDA,治疗类风湿性关节炎。目前国内也已经有多家企业开始布局二代JAK,在MNC的产品在国内登陆以前,应还有3-4年的时间窗
❖美国FDA批准罗氏开发的NTRK,ROS1抑制剂Rozlytrek上市,这是FDA继Keytruda和Vitrakvi之后,批准的第三款不限癌种的肿瘤疗法。异病同治一直是临床的核心诉求之一。不过由于肿瘤分化的异质性,目前能实现该愿望的治疗集中在少数几个信号通路中,除了TRK抑制剂外,RET和FGFR也是不限癌种疗法聚焦的焦点,blueprint的BLU667和BLU554分别针对这2个靶点,目前在全球的实验也走在前列,后续有可能会成就第四款异病同治的产品
阿斯利康靶向DNA损伤修复机制的AZD1775,
在治疗胰腺癌患者的1期临床试验中,有效延长了患者OS
阿斯利康(AstraZeneca)靶向DNA损伤修复机制的在研疗法AZD1775,与化疗和放疗联用,在治疗新确诊的局部晚期胰腺癌患者的1期临床试验中取得积极结果,延长了患者的总生存期
AZD1775是Wee1的抑制剂,在DNA损伤修复中发挥重要作用
1期临床试验招募了34例局部晚期胰腺癌患者。除放疗和使用化疗药物吉他西滨外,患者还接受不同剂量的AZD1775
所有患者在该临床试验的中位OS为22个月,而单独使用吉他西滨治疗的患者OS为12-14个月
FDA批准新基的Inrebic用于治疗中危-2和高危
(intermediate-2/high-risk)原发性或继发性骨髓纤维化患者
FDA批准新基的Inrebic上市,治疗中危-2和高危(intermediate-2/high-risk)原发性或继发性骨髓纤维化患者
Inrebic(fedratinib)是一款口服JAK2和FLT3抑制剂
在2期试验和关键性3期试验总,总计608名患者接受了Inrebic的治疗,其中459名患有骨髓纤维化,97名患者曾经接受过ruxolitinib的治疗
在未接受过JAK抑制剂治疗的患者中,37%接受Inrebic治疗的患者脾脏体积缩小>35%,而且40%的患者骨髓纤维化综合评分改善超过50%,这两项指标均显著优于安慰剂组(分别为1%,和9%)
JAK2的作用机制
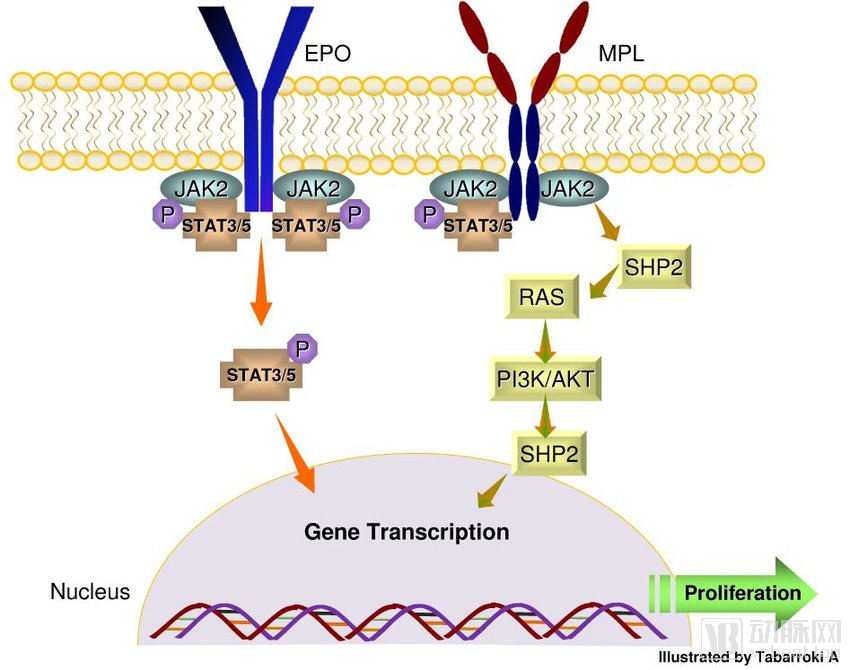
数据来源:Research gate
FDA批准艾伯维的Rinvoq(upadacitinib)上市,
治疗中度至重度活动性风湿性关节炎(active RA)成年患者
FDA批准Rinvoq(upadacitinib)上市,治疗中度至重度活动性风湿性关节炎(active RA)成年患者。这些患者对氨甲喋呤(MTX)反应不良或者不耐受
Rinvoq(upadacitinib)是一款每日口服一次的小分子JAK1选择性抑制剂
在SELECT这一3期临床研究中,包含5个临床试验,总计入组患者接近4400名
超过30%的患者在接受Rinvoq治疗后能够进入临床缓解期(clinical remission)。这时患者即使不使用MTX,也几乎不会出现疾病活动和症状。临床缓解期的持续时间可高达26周
美国FDA批准Wakix (pitolisant)用于治疗成年发作性
睡病(narcolepsy)患者的白日过度嗜睡 (EDS)
美国FDA批准Wakix (pitolisant)用于治疗成年发作性睡病(narcolepsy)患者的白日过度嗜睡 (EDS)
Wakix是一款“first-in-class”的选择性组胺3(h3)受体拮抗剂/反向激动剂
在两项多中心、随机、双盲、安慰剂对照研究中,共入组261名患者,随机接受Wakix、安慰剂或阳性对照药物,治疗持续时间为八周。
Wakix通过测量爱华睡眠量表(ESS)得分,证明了在 EDS方面有统计学意义上的显著改善
美国FDA批准罗氏(Roche)公司开发的NTRK,
ROS1和ALK抑制剂Rozlytrek(entrectinib)上市
美国FDA批准罗氏(Roche)公司开发的NTRK,ROS1和ALK抑制剂Rozlytrek(entrectinib)上市,治疗携带NTRK基因融合的实体瘤患者,以及携带ROS1基因突变的非小细胞肺癌患者
Rozlytrek是一款针对NTRK和ROS1基因融合而设计的特异性酪氨酸激酶抑制剂,它能够抑制TRK A/B/C和ROS1激酶活性
本次批准主要基于STARTRK-2的关键性2期临床试验
在NTRK融合阳性实体瘤患者中,Rozlytrek达到57.4%的客观缓解率(ORR),中位缓解持续时间(DOR)达到10.4个月。多达10种不同类型的实体瘤患者对这一疗法产生响应。
再生元公司宣布其靶向创新靶点血管生成素样蛋白3(ANGPTL3)的evinacumab,
在3期临床试验获得积极结果
再生元(Regeneron Pharmaceuticals)公司宣布,靶向创新靶点血管生成素样蛋白3(ANGPTL3)的evinacumab,在关键性3期临床试验获得积极结果
Evinacumab是一种针对血管生成素样蛋白3(ANGPTL3)的单克隆抗体
ELIPSE HoFH是一项正在进行的随机双盲、安慰剂对照的3期临床试验。65名12岁以上的HoFH患者在接受已有降脂疗法同时,接受evinacumab或安慰剂的治疗
与安慰剂组相比,LDL胆固醇水平降低49%(evinacumab组降低47%,安慰剂组增加2%,p<0.0001),47%的受试者LDL胆固醇水平低于100 mg/dL,而安慰剂组只有23%(p=0.0203)
ANGPTL3的降脂机制
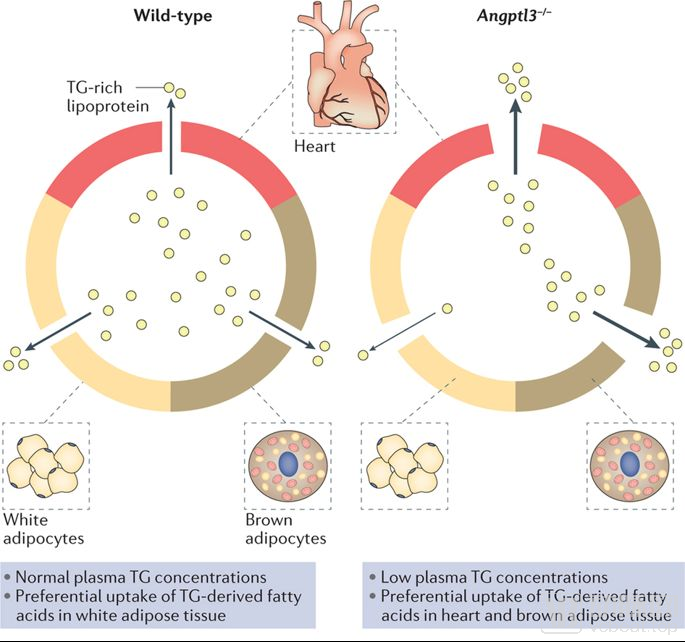
数据来源:nature review
AZ的 Lynparza(olaparib)与beviacizumab联用,
作为一线维持疗法,在卵巢癌的3期试验中达到主要终点
AZ与MSD联合开发的重磅PARP抑制剂Lynparza(olaparib),与beviacizumab联用,作为一线维持疗法,在治疗晚期卵巢癌患者的3期临床试验中达到主要终点
Lynparza是一款“first-in-class”PARP抑制剂,它靶向DNA损伤修复反应(DDR)通路
在随机双盲3期临床试验中,接受一线铂基疗法获得完全或部分缓解的晚期卵巢癌患者,接受了Lynparza+bevacizumab或bevacizumab的治疗。Bevacizumab是治疗这类患者的标准疗法
Lynparza与bevacizumab构成的组合疗法,与标准疗法组相比,给患者的无进展生存期(PFS)带来统计显著且具有临床意义的改善
AZ的BTK抑制剂获得FDA授予的突破性疗法认定,
作为单药疗法治疗慢性淋巴性白血病(CLL)成年患者
AZ的布鲁顿酪氨酸激酶(BTK)抑制剂Calquence(acalabrutinib),获得FDA授予的突破性疗法认定,作为单药疗法治疗慢性淋巴性白血病(CLL)成年患者
Calquence是一款BTK抑制剂,它通过与BTK共价结合,抑制它的活性
在全球性随机,多中心,开放标签3期试验ASCEND中,接受过一次前期治疗的310名患者接受Calquence或标准组合疗法的治疗
Calquence单药疗法 与活性对照组相比,将患者疾病进展或死亡风险降低了69%(HR,0.31:95% CI,0.20-0.49, p<0.0001)
Deciphera公司宣布ripretinib的关键性3期临床试验
INVICTUS的积极顶线数据,末线治疗GIST患者
Deciphera公司宣布ripretinib的关键性3期临床试验INVICTUS的积极顶线数据,ripretinib是一种KIT和PDGFRα抑制剂,用于治疗四线及四线以上的胃肠道间质瘤(GIST)患者。
Ripretinib是一种KIT或PDGFRα激酶抑制剂
3期临床试验INVICTUS是一项随机、双盲、多中心、安慰剂对照的国际性研究,129名患者按照2:1的比例接受ripretinib或安慰剂的治疗
ripretinib达到了改善PFS的主要终点。接受ripretinib治疗的患者的PFS为27.6周,而安慰剂组的PFS仅为4.1周。此外使用ripretinib治疗的患者OS为15.1个月,而安慰剂组仅为6.6个月
美国FDA批准TB Alliance开发的pretomanid上市,
与贝达喹啉等联用,治疗特定高度耐药肺结核(TB)患者
美国FDA宣布,批准由非盈利组织全球结核病药物开发联盟(TB Alliance)开发的pretomanid上市,与贝达喹啉(bedaquiline)和利奈唑胺(linezolid)联用,治疗特定高度耐药肺结核(TB)患者
Pretomanid是一种新化学实体
在名为Nix-TB的关键性临床试验中,109名患者包括广泛耐药性TB患者,和对已有疗法不耐受或无反应的多重耐药性患者
在接受治疗6个月之后,这一组合疗法的成功率达到89%,显著高于治疗广泛耐药TB患者的历史成功率
❖CDE最新公示, Sanofi旗下 Genzyme公司在研新药fitusiran注射液(创新RNAi疗法)的临床试验申请获得默示许可,适应症为:用于治疗有或没有抑制性抗体的A型或B型血友病成年患者和12岁以上的青少年患者
❖德国默克(Merck KGaA)在研抗肿瘤新药(代号:M7824)治疗非小细胞肺癌(NSCLC)在中国的临床试验获得默示许可。今年2月,葛兰素史克(GSK)曾与德国默克达成该药的全球合作协议,后者可能获得总计37亿欧元的付款
❖ AskBio公司宣布并购致力于开发合成基因启动子的Synpromics公司,双方的合作旨在实现更精准的细胞靶向和基因表达,进一步改良基因疗法。AskBio公司专注于开发腺相关病毒(AAV)基因疗法。它独创AAV技术平台能够使用基因工程手段,对AAV的衣壳蛋白进行修改,从而构建具有新型衣壳蛋白的AAV
❖鼎航医药(Oncologie)公司宣布与默沙东(MSD)达成一项临床试验合作协议,评估其在研抗磷脂酰丝氨酸(PS)抗体bavituximab与默沙东的抗PD-1疗法Keytruda构成的组合疗法,治疗晚期胃癌或食管胃结合部癌患者的疗效
❖勃林格殷格翰(Boehringer Ingelheim)公司和德克萨斯大学MD安德森癌症中心(UT MD Anderson Cancer Center)宣布达成一项新的多年合作,双方将共同开发多种创新抗癌疗法,其中包括治疗胃肠癌和肺癌的KRAS抑制剂
❖再鼎医药(Zai Lab)和Novocure公司宣布,肿瘤治疗电场(Tumor Treating Fields,TTF)产品Optune获得中国国家药品监督管理局(NMPA)授予的创新医疗器械认定(Innovative Medical Device Designation),用于治疗患有多发性胶质母细胞瘤(glioblastoma,GBM)的成人患者(22岁或以上)
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。