
# 热门搜索 #
肿瘤细胞免疫治疗之CAR-T技术(上):技术优势、风险与几大应用场景
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持探针资本独立出品,欢迎共同讨论~请加微信号S-caffeine
过继性细胞治疗是细胞的免疫治疗一个主要研究方向。过继免疫细胞输注(adoptive cell transfer, ACT)属于肿瘤的被动免疫疗法,指的是分离肿瘤患者自体肿瘤浸润淋巴细胞( tumor-infiltrating lymphocytes,TIL)或者外周血淋巴细胞,在体外加以分选、扩增、活化,并回输至患者体内。
在恶性黑色素瘤和肾细胞癌,TIL是常用的ACT治疗。TIL是浸润于肿瘤中的淋巴细胞,分离后在IL-2等因子作用下进行体外扩增,最后再回输到患者体内。然而,多数情况下无法应用TIL:有些患者缺乏肿瘤标本或肿瘤和转移灶中TIL很少;获得新鲜的肿瘤组织并分离和扩增TIL 具有难度;回输的TIL 细胞功能受损,在体内往往不能有效识别肿瘤细胞; 肿瘤中强大的免疫抑制微环境降低回输细胞的杀伤能力。这些问题限制了TIL的广泛应用,仅对如恶性黑色素瘤和肾细胞癌的少数肿瘤有一定疗效,对大多数肿瘤疗效欠佳。
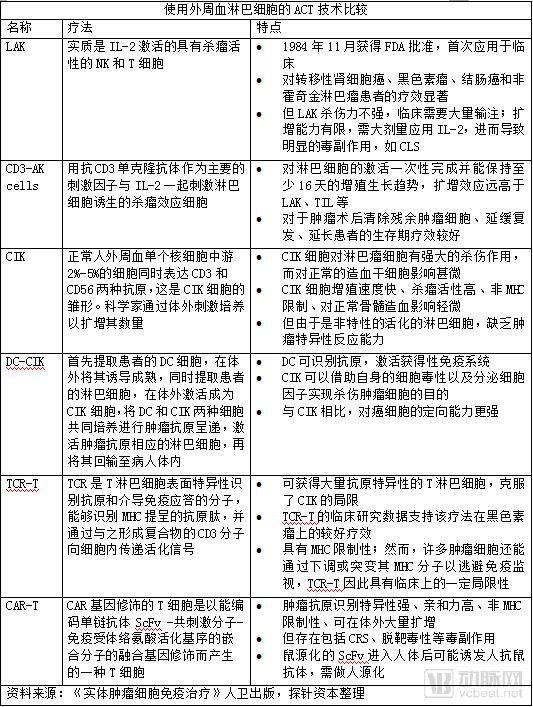
在这种情况下,ACT需要使用外周血淋巴细胞。目前使用外周血淋巴细胞的ACT包括淋巴因子激活的杀伤细胞(lymphokine activated killer cells,LAK)、细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)、树突细胞-细胞因子诱导杀伤细胞(dendritic cells-cytokine induced killer,DC-CIK)、抗CD3抗体诱导的活化杀伤细胞(anti-CD3 antibody-induced activated killer cells, CD3-AK cells)等。然而CIK等是非特异性活化的淋巴细胞,缺乏肿瘤特异性反应能力。
在这种情况下,科学家开始通过基因修饰,将识别肿瘤抗原的T细胞受体(T cell receptor, TCR)或CAR基因导入淋巴细胞使之成为TCR基因修饰T淋巴细胞(TCR-T)或CAR-T细胞,使之具备肿瘤抗原靶向识别能力。
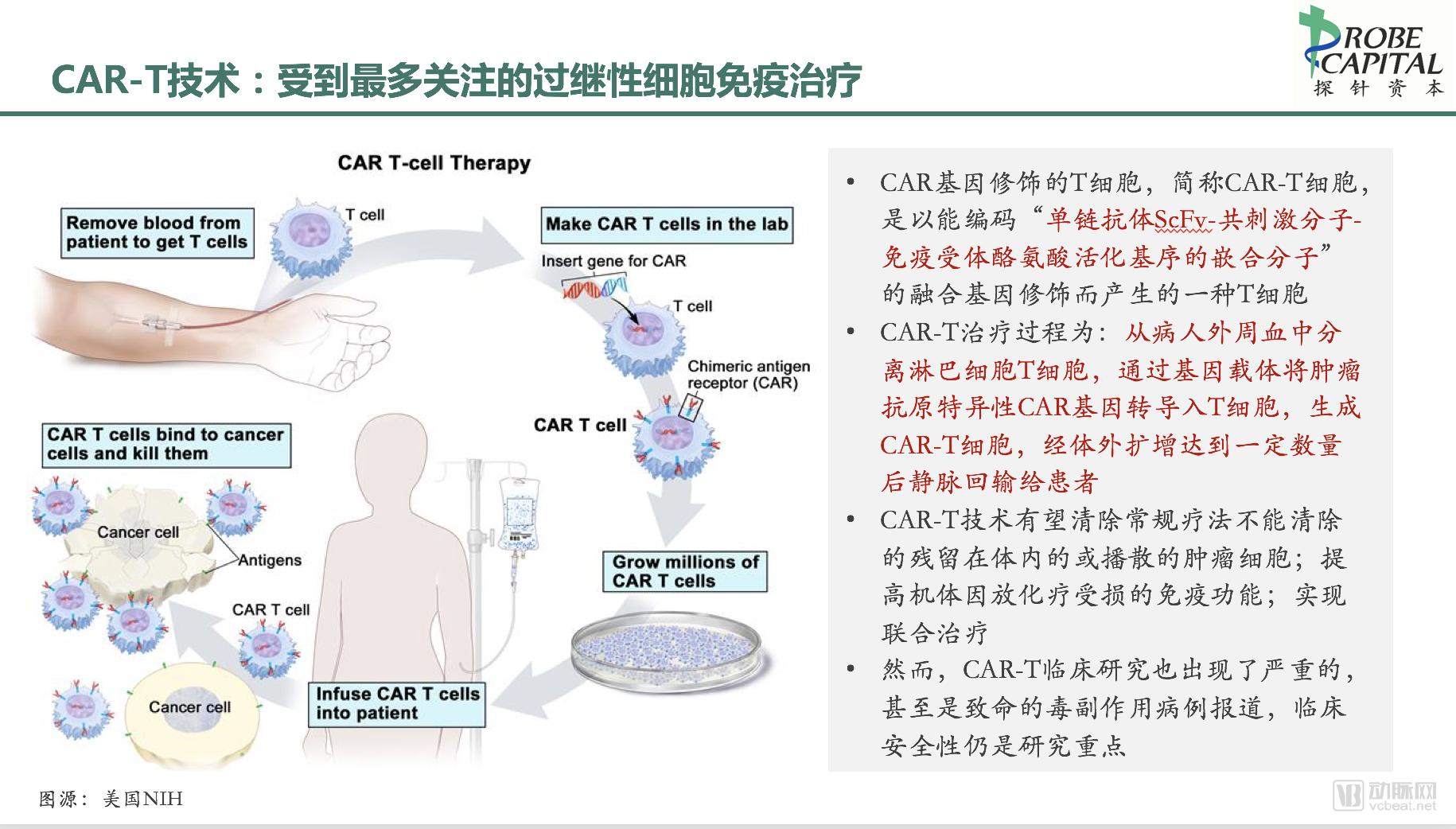
简单来说,CAR-T治疗过程为包括从病人外周血中分离淋巴细胞T细胞,通过基因载体将肿瘤抗原特异性CAR基因转导入T细胞,生成CAR-T细胞,经体外扩增达到一定数量后静脉回输给患者。由于被转录的CAR基因编辑的功能,回输的CAR-T可以特异性结合癌症细胞,从而达到靶向治疗的作用。
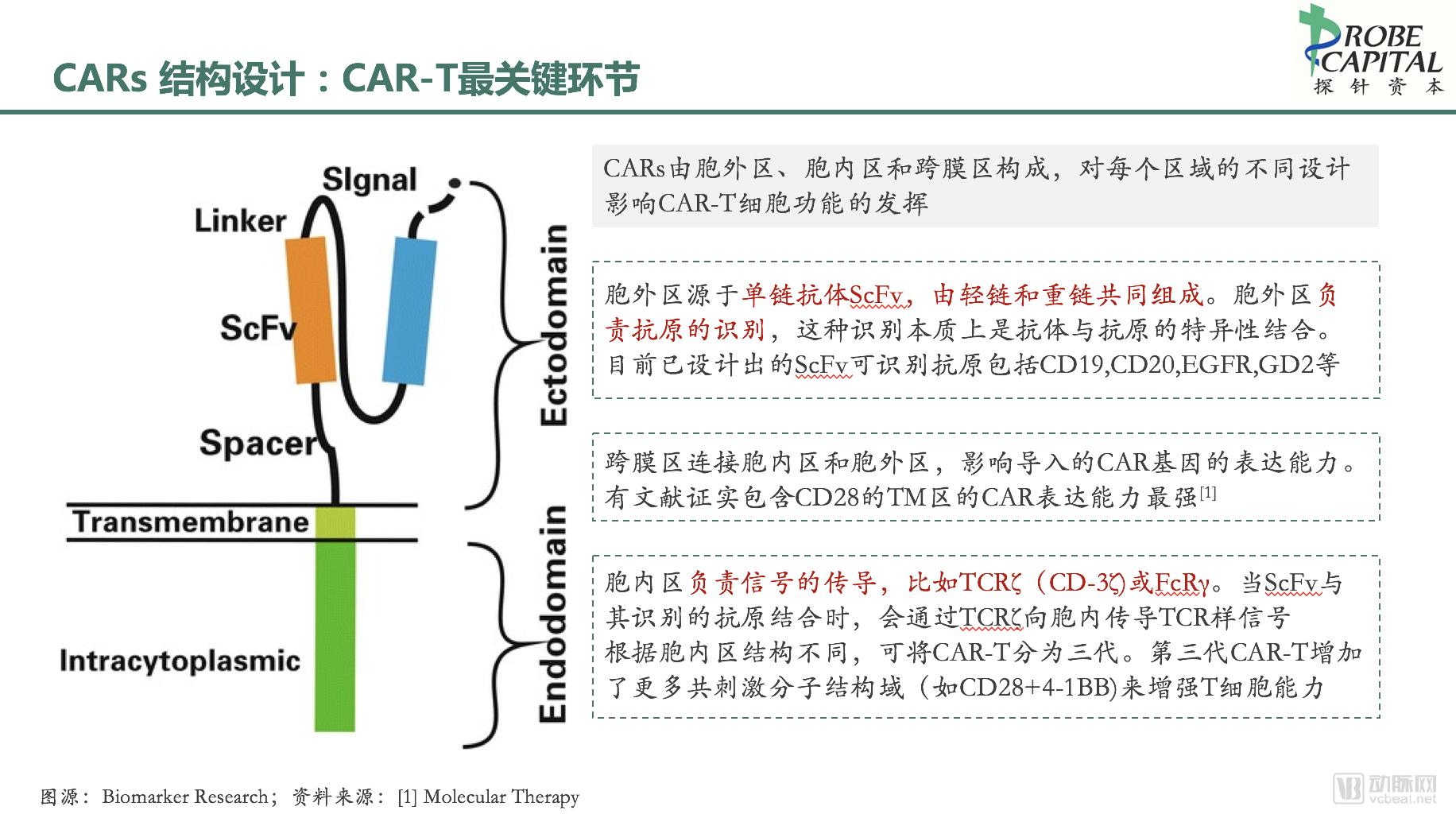
CARs是靶向目标表面分子的重组受体,其结构主要包括胞外抗原结合域、跨膜区和胞内信号区三部分,对每个区域的不同设计影响CAR-T细胞功能的发挥。
胞外区源于单链抗体ScFv,由轻链和重链共同组成,负责抗原的识别。这种识别本质上是抗体与抗原的特异性结合,不需要依赖于MHC的递呈,有效避免了肿瘤细胞MHC表达下调这一免疫逃逸机制。CAR不仅能够识别肽类抗原,还能识别糖类和糖脂类抗原,更加广谱地杀伤肿瘤细胞。
目前已设计出的ScFv可识别抗原包括CD19、CD20、EGFR、Her2/neu、GD2、PSMA及RORI等。
跨膜区连接胞内区和胞外区,一般由二聚体膜蛋白组成,将CARs结构锚定于T 细胞膜上。
跨膜区的不同设计影响导入的CAR基因的表达能力。有文献证实包含CD28的TM区的CAR表达能力最强,其次是包含OX40的CAR,而包含CD3ζ的CAR表达能力最差。目前设计用于CAR的TM区主要包括H2-Kb、CD4、CD7、CD8、CD28等。
胞内信号域采用免疫受体酪氨酸活化基序( immune-receptor tyrosine-based activation motifs,ITAM) ,通常是 TCRζ(CD-3ζ)或FcRγ,当胞外区ScFv与其识别的抗原结合时,就会向胞内传导 TCR 样信号。根据胞内区结构不同,可将CAR-T分为四代。
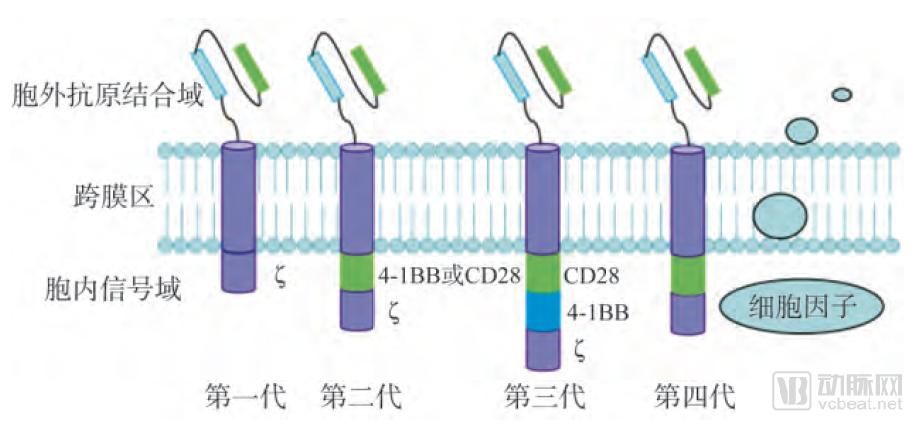
根据胞内区结构不同,CARs结构经历了从第一代到第四代的变迁。
图源:中国知网
第一代CAR只有一个胞内信号组份,主要是CD-3ζ或FcRγ。当第一代CAR受到特异性抗原识别并激发后,可为T细胞提供活化信号,并通过胞内结构域传导该信号,引起细胞的活化,表现为CAR依赖的细胞活化及细胞杀伤作用,分泌穿孔蛋白、颗粒酶及细胞因子,协同作用杀死肿瘤细胞。早期的实验证明了CAR-T的可行性,是首次不依赖人类白细胞抗原进行T细胞激活的尝试。然而,第一代CAR只能引起短暂地激活T细胞和分泌较低水平的细胞因子,不能提供长时间的T细胞扩增信号和持续的体内抗肿瘤效应。
为了解决这个问题,从第二代CAR开始引入了共刺激分子信号序列(costimulatory molecule,CM),如CD28、CD137(4-1BB)。与第一代CAR相比,第二代CAR含有一个活化结构域和一个共刺激区域,在保持抗原特异性一致的情况下,增强了T细胞增殖和细胞因子分泌的功能。
第三代CAR在前一版本上升级,胞内部分则由活化结构域和多重共刺激区域组成,具有三个胞内信号域,其中包括两个串联的共刺激域CD28、4-1BB或OX40和一个CD-3ζ。这些结构域的增加不仅能够加强CAR-T细胞特异性识别肿瘤抗原及结合等能力,更能够显著扩大由胞外区传递的细胞信号,引起下级细胞杀伤作用的级联放大,抗肿瘤能力更强。
第四代CAR是最近出现的新型CAR,又称TRUCKs ( fourth-generation CAR T-cells redirected for universal cytokine killing)。它的结构与前三代不同,引入促炎症细胞因子(如IL-12) 和共刺激配体( 4-1BBL 和CD40L) ,可以在具有免疫抑制性的肿瘤微环境中通过释放促炎性因子,招募并活化更多的免疫细胞而引起更为广泛的抗肿瘤免疫效应。同时,第四代CAR的出现可使患者免受回输前预处理治疗(如全身照射或大剂量化疗)的不良反应,减少回输细胞总量,拓宽了CAR-T 细胞的临床应用范围。
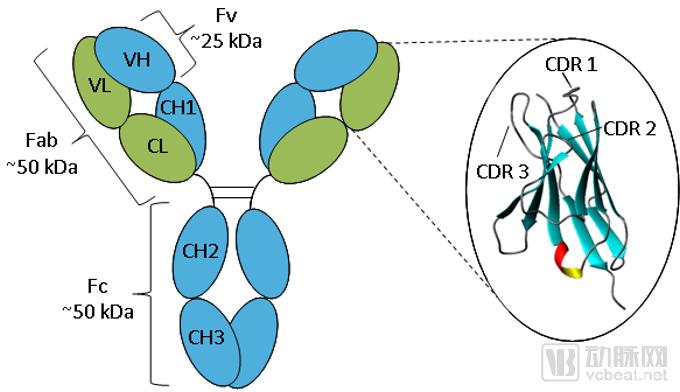
图源:Absolute Antibody
传统抗体是分子量为150 k Da的四聚体多肽,由两对相同的重链(50 k Da)和轻链(25k Da)多肽组成,二者由链间的二硫键链接,形成Y型或T型结构。其中,轻链由N端的可变区(VL)和C端的一个保守的区域(CL)构成;重链由N端的可变区(VH)和三至四个恒定的区域(CH1,CH2,CH3,可能CH4)组成。
可变区的多样性决定了抗体的多样性与特异性,使得抗体具有结合特定抗原的能力。比较不同特异性抗体的VL和VH的氨基酸顺序显示,变异仅集中在其中少数区域的氨基酸上(15%~20%),称为超变区。超变区是抗体的抗原结合位,与抗原决定簇的结构互补,故又称为互补决定区(complementarity-determining regions,CDRs)。
胞外抗原结合域源于抗体的抗原结合基序,可以连接受体上的VH和VL区域,形成单链可变区scFvs,从而特异性识别肿瘤抗原。
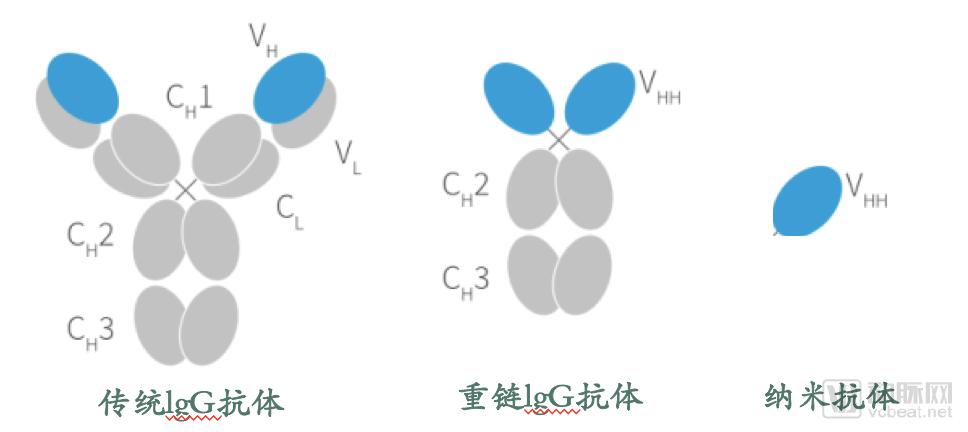
骆驼和鲨鱼类动物体内存在着天然缺失轻链的重链抗体,由体内两条同源的重链肽段组成,相对分子质量为90 kDa。如果克隆其可变区VHH,将得到只由一个重链可变区组成的单域抗体,是目前可以得到的具有完整功能、稳定、可结合抗原的最小单位,又称纳米抗体,相对分子质量仅为15 kDa,仅为常规抗体的1/10左右。
纳米抗体的VHH和人抗体重链可变区VH结构非常相似,其基因同源性达90%。纳米抗体VHH表面大概只有10个氨基酸和人VH不同,其中在FR2位置有四个特异的氨基酸:普通抗体的FR2中V37、G44、L45和W47这4个氨基酸残基是在进化中相当保守的疏水性残基;而在VHH中,它们突变为亲水性的氨基酸残基F37、E44、R45、G47,增加了VHH的溶解性。
VHH的CDR1区和骨架区FR2存在半胱氨酸残基(Cys),可以和CDR3区中的Cys残基形成二硫桥,增加了可变区的稳定性和结构变化。VHH的FR2区中特殊的亲水性氨基酸残基的改变和CDR3区二硫键的存在,也使得其稳定性和亲水性也远远优于传统的抗体。
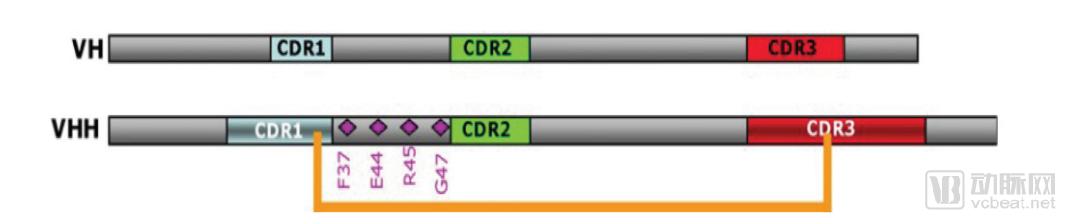
VH 和VHH 结构示意图
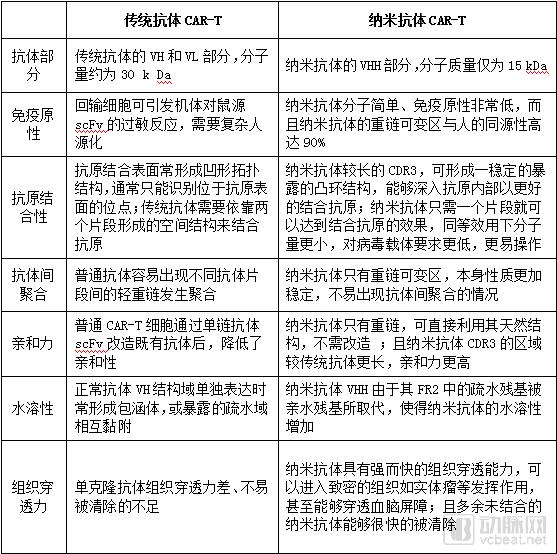
相比于传统CAR-T,搭载纳米抗体的CAR-T在性能上有更多优势。
稳定转染是效应T细胞稳定表达CAR的前提。目前用于CAR-T的基因转导的方法主要有逆转录病毒转导、慢病毒转导和mRNA转染。
逆转录病毒科包含七个成员,其中γ-逆转录病毒已成为治疗恶性肿瘤的临床基因转移常用载体。然而近年来,由于逆转录病毒转导有引起插入致瘤的风险、不能感染非分裂细胞、病毒滴度低等问题,在临床试验中已经逐渐被慢病毒转导所取代。
慢病毒载体含有顺式作用元件中央多聚嘌呤区,因而慢病毒不受细胞分裂的控制,能够在更广泛的细胞类型里进行有效的转导,包括静止细胞的转导。并且,慢病毒载体的整合位点更安全,转基因负荷量更大,基因毒性更小。在靶向CD19的CAR-T临床试验中,慢病毒传染的CAR-T显示出更显著的抗肿瘤效力。
当需要获得短暂存在的CAR-T细胞时,则需要用到mRNA转染。mRNA转染是一种快速高效的转染方式,T细胞在一周内瞬时表达,不能稳定持久存在,往往需要输注大量的T细胞才能够保证疗效。
总的来说,从原理、结构和制作工艺上,目前的CAR-T都比TIL和TCR更有优势。
一、CAR-T细胞不受MHC限制,是抗原与抗体的特异性识别,能够更加有效地杀伤具备抗原特异性的肿瘤细胞。而TIL和TCR均只能识别MHC提呈的抗原,可能因肿瘤细胞下调或突变其MHC分子而逃避免疫监视,临床上有一定局限性。
二、CAR-T细胞疗法使用剂量比TIL和TCR-T下降了2--3个数量级。由于CAR-T细胞治疗靶点明确,具有高度识别肿瘤表面抗原的特异性,同时克服了 MHC限制性,因而在同样的治疗效果下,CAR-T疗法的单次注输细胞数量(1000万-1亿)远远少于TCR-T(10亿-100亿)和TIL(100亿-1500亿)。
三、CAR-T细胞疗法所需时间更短。由于同等治疗效果下CAR-T所需细胞数量更少,因而CAR-T培养T细胞所需时间最短。体外培育周期缩短至2周,大幅节约了时间成本。
四、CAR不仅能够识别肽类抗原,还能识别糖类和糖脂类抗原,扩大了肿瘤抗原靶点范围。出来不受MHC限制,CAR-T疗法也不受肿瘤细胞的蛋白质抗原限制,CAR-T可以利用肿瘤细胞的糖脂类非蛋白质抗原,更能够多维度识别抗原。
五、CAR-T具有一定的广谱可复制性。由于某些位点会在多种肿瘤细胞中表达,如EGFR,针对这种抗原的CAR基因一旦构建完成,便可以被广泛利用。
六、CAR-T细胞具有免疫记忆功能,能够长期在体内存活。这对预防肿瘤复发具有重要临床意义。
脱靶效应(off-target toxicity)是所有过继性细胞免疫治疗的共性问题,它的概念要和正常组织毒性(on-target toxicity)区别开。
正常组织毒性指基因修饰T细胞对同样表达其靶点的正常组织的毒性。脱靶效应是指基因修饰T细胞对不表达这些靶分子的正常组织或器官的毒性。
如何鉴定出肿瘤细胞上合适的免疫原性的靶点,从而使得CAR-T细胞只攻击肿瘤细胞而不损伤正常组织,是CAR-T发展的关键。有一种做法是,通过设计多个抗原复合的CAR结构,识别抗原组合,能够提高杀伤的特异性,如Wilkie实验室使用同时靶向抗原ErbB2和MUC1的CAR-T治疗乳腺癌。
当CAR-T细胞被回输至体内,细胞治疗过程中会释放的大量细胞因子,包括 IL-6、TNFα 和 IFNγ,这些炎性介质促发急性炎症反应诱导上皮及组织损伤,导致微血管渗漏等机体多种免疫炎症反应,称之为细胞因子风暴( cytokine release syndrome,CRS)。CRS发生于超过半数的CAR-T受试者,是最常见的不良反应之一。
CRS可发生于细胞输注后2-3周,常见症状为发热、寒战、疲劳、低血压、恶心、头痛、心动过速、呼吸困难,以及心、肝、肾功能异常等。
CRS的发生于CAR的结构、肿瘤负荷及类型以及患者基因多态性相关,可通过设计安全的CARs并严格限制每次输注的细胞数量来降低发生风险。或者可导入一个安全开关控制基因,如可诱导的Caspase 9,当此基因被某种可溶性的因子诱导表达时,可引起 CAR-T细胞凋亡,有助于降低细胞的毒性反应。并且,当CRS发生后,也可利用托珠单抗等药物进行治疗、控制。
另一常见的不良反应为神经毒性。在成功利用托珠单抗治疗CRS之后,神经毒性已成为CAR-T治疗过程中的主要生命威胁事件,其发生机制仍有待探索。
多项临床试验曾报道包括脑梗死、谵妄、意识不清、抽搐、神经麻痹、视野缺损、共济失调、言语障碍在内的多种神经系统异常症状。
美国Juno Therapeutics公司正是因其临床试验中出现5例不可预期的脑水肿死亡,而不得不宣布关停“火箭计划”项目的临床试验。Juno分析推测神经毒性可能由预处理化疗药物氟达拉滨或CAR-T产品结构中的CD28共刺激结构域引起。
CAR-T尚有某些其他的毒副作用,如出凝血功能障碍、B细胞发育不良等。
其中凝血功能障碍主要表现为散在瘀斑瘀点、血栓形成及实验室指标异常,如血小板减少、D-二聚体升高、纤维蛋白原降低、纤维蛋白降解产物升高、活化部分凝血活酶时间延长等。
B细胞发育不良则主要是因为针对肿瘤细胞的靶点(如CD19)同样表达于正常B细胞表面,从而CAR-T细胞在清除肿瘤细胞的同时也会杀灭正常B细胞。且CAR-T细胞可在体内长期存续和发挥作用,因此患者体内可长期缺乏正常B细胞,造成丙种球蛋白低下,易形成感染。因此患者需要适当补充丙种球蛋白提高免疫力作为预防措施。
当CAR-T应用于实体瘤治疗时,还可能造成CAR-T细胞归巢和免疫抑制肿瘤微环境等问题。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。