
# 热门搜索 #
肿瘤细胞免疫治疗之CAR-T技术(下):国内经典企业及产品详细解析,中国制造或将弯道超车
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持南京传奇成立于2014年,为金斯瑞旗下子公司,该公司专注于研究和发展免疫治疗中嵌合抗原受体细胞技术。其靶向BCMA 的CAR-T 疗法LCAR-B38M CAR-T在中国的临床申请获批,为全国首例。
南京传奇具有创新的双表位技术。其技术与海外公司技术不同的是:
1)采用双表位技术,可以同时针对 BCMA 的2个表位,因此脱靶率低,副作用小,临床效果更好;
2)采用羊驼纳米抗体:羊驼抗体仅有可变区重链,没有轻链,好处是相较于鼠源的ScFV,羊驼重链序列与人高度相似,免疫原性较小,并且由于没有轻链,不易自聚,因此持久性较强。
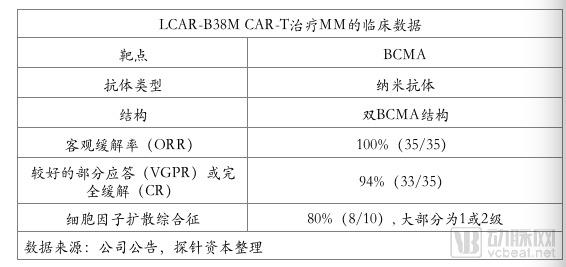
2017年6月5日,在ASCO年会上,南京传奇生物公布其靶向BCMA的针对多发性骨髓瘤(MM)自主研发的细胞疗法临床数据,引起业界的极大震动。在35 名接受既往治疗后复发的多发性骨髓瘤(MM)患者中,有33 人(94%)治疗后2 个月获得临床缓解,显示明显的骨髓瘤临床缓解迹象(CR 或VGPR),客观缓解率(ORR)达到100%。在最早接受治疗的19例患者中,南京传奇对其观察随访4-14个月以上。其中14名患者持续达到严格完全反应诊断标准,5位出现部分缓解。该试验中 5名经治超过1年的患者仍然处于sCR 期。
在副作用方面,10名患者中有8名出现细胞因子释放综合症,大部分均为暂时性的或症状较轻的1级或2级。
2017 年9月观察三个月以上时,结果更新为三线治疗无效的40名患者中,ORR 97.5%,CR 60%,VGPR 30%,PR 7.5%,治愈率仍然非常高。结果好于Bluebird和诺华的BCMA产品。
2017年12月11日,南京传奇生物 CAR-T 技术产品“LCAR-B38M CAR-T细胞自体回输制剂”临床申请IND,获CDE 受理,并进入了第二十五批优先审评程序,加快产品审评速度。2018年3月12日该CAR-T产品获批,为全国首例,预计2018年初提交美国IND。该产品按照生物制品1类申请注册,靶向 B 细胞成熟抗原(BCMA,CD269)。
2017年12月22日,强生旗下制药公司 Janssen Biotech, Inc. 宣布与传奇生物签订合作协议,传奇生物将授予其关于LCAR-B38M 的全球研发、生产和销售许可。公告指出,在海外地区,传奇生物与Janssen Biotech将五五分成费用和利润,国内按照7:3的比例共同承担成本及分享收益。
在合作之初,Janssen将支付3.5亿美元的先期资金。随着开发与监管等里程碑的到来,Janssen将提供额外的资金。
恒润达生成立于2015年,位于上海张江,是专注于细胞免疫治疗的新型生物科技企业。主要研究方向包括CAR-T细胞治疗项目、新型DC疫苗治疗项目、干细胞基因改造iNKT细胞治疗项目和CAR-NK细胞治疗项目。
公司目前开展了大量处于临床前和临床Ⅰ期的CAR-T项目,目前已获得由国家药品监督管理局颁发的两个抗人CD19 T细胞注射液《药物临床试验批件》:批文号2018L02734用于治疗复发/难治性CD19阳性的弥漫性大B细胞淋巴瘤和滤泡性淋巴瘤;批文号2018L02739用于治疗复发/难治性的CD19阳性B细胞急性淋巴细胞白血病(ALL)。2018年05月31日,公司的另一款靶向BCMA的CAR-T产品“抗人BCMA T细胞注射液”也申报了IND,目前尚在审批中。恒润达生是继南京传奇和药明巨诺后,国内第三家获得CAR-T临床批件的公司。
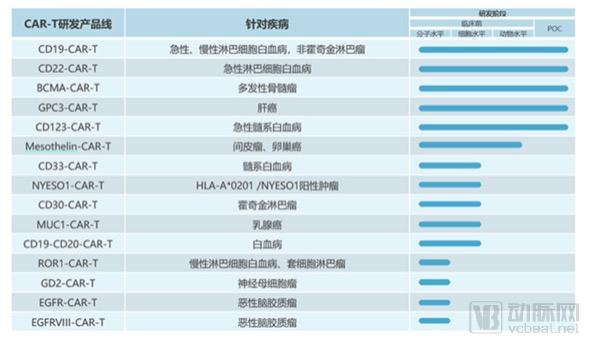
公司在ClinicalTrials上注册的8个临床试验,设计疾病包括:多发性骨髓瘤、成人及儿童B细胞白血病、B细胞淋巴瘤及CD22 CAR治疗CD19 CAR治疗失败或复发的B细胞淋巴瘤。拥有15个产品管线。
其靶向CD19的CAR-T产品MatchCAR治疗复发难治性B细胞白血病项目,在河南省中医院血液科和徐州医科大学第二附属医院血液科入组15例患者,完成回输的患者11例,目前所有回输的患者均达到了完全缓解(CR)(NCT02685670);在第三军医大学新桥医院入组复发难治性B淋巴瘤患者10例,完成回输的患者8例,其中5例患者(62.5%)有不同程度的客观缓解率(CR+PR)(NCT02652910)。
恒润达生研发管线
图片来源:恒润达生官网
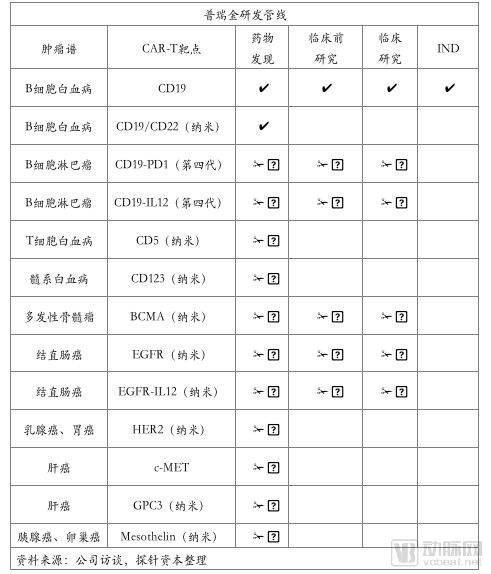
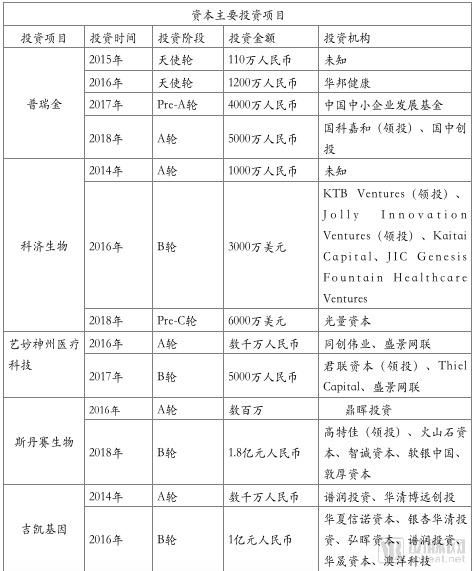
普瑞金科技成立于2012年11月,是拥有独家自主知识产权的融合纳米抗体平台,国内较早致力于按照药物标准研发CAR-T疗法的细胞药物专业公司。
普瑞金投资建立羊驼养殖与抗体免疫研发基地,搭建了纳米抗体技术平台,自主掌握了全线的抗原制备、免疫抗原、建库筛选、抗体生产全线纳米抗体产业化技术,将生产成本降至普通抗体1/10,达到质控标准。
“纳米抗体+CAR-T协同开发”是普瑞金目前主要的研发管线。2018年6月14日,普瑞金生物的首个项目申报临床,此次申报的“靶向CD19的嵌合抗原受体T细胞注射液”适应症为B细胞急性淋巴细胞白血病(B-ALL),预计10月获得临床批件。
普瑞金的靶向CD19产品目前已临床入组20例,其中采用加入安全开关的更新CART产品有9例患者,其中8例出现CR,CR率达89%。同时,安全开关的加入也降低了毒副反应,虽然有6例患者出现不良反应事件,但没有患者出现3/4AE、SAE或2级以上的CRS。
另外,同款CD19产品还在开展治疗淋巴瘤的临床试验,目前已入组患者16例,其中两例使用添加安全局开关的CD19产品,均达到CR。
同时,普瑞金正在进行多项CAR-T临床研究,累计治疗患者近百例。后续产品管线丰富。
博生吉成立于2010年05月31日,公司经营范围包括研发癌症诊断试剂盒、抗癌药物、生物医药制品等。2015年6月,安科生物出资2000万增资博生吉,占15%股份,使得博生吉成功建设了功能齐全的CAR-T细胞制备GMP车间。
2016年2月,安科生物再次获得博生吉5%的股份,同年十月,两家公司成立合资公司博生吉安科。在细胞治疗领域,博生吉在 CAR-T、CAR-NK疗法的研究处在国内前列,安科生物通过参股博生吉重点覆盖 CAR-T 和CAR-NK等细胞治疗领域。
2017年12月28日,博生吉安科提交的“靶向 CD19 嵌合抗原受体 T 细胞输注剂”新药临床试验申请,获得 CFDA正式受理。2018年1月博生吉安科与德国美天旎公司达成合作谅解备忘录在合肥建设基于CliniMACS Prodigy 和 MACSQuant 平台的全自动 CAR-T 细胞制备工厂,提高全自动生产和质控技术。
博生吉安科目前已经有多个 CAR-T 项目处于临床试验阶段,以 CD19 为靶点的 CAR-T 产品于 2016 年 10 月正式启动临床试验,结果理想,完全缓解率达到 90% 及以上。
目前除了 CD19 靶点,还有 3 个靶点处于临床试验阶段;博生吉安科同时布局实体肿瘤(肺癌、胰腺癌),靶点为 MUC1,临床试验获得疗效。根据已有数据显示博生吉安科的 CAR-T 产品在 CRS 致死、神经毒性、制备失败率等风险值上优于诺华、Kite、Juno 同靶点产品,具有优秀的风险管控能力。
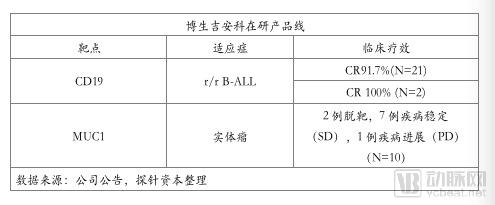
在 CD19 CAR-T 细胞(靶向 CD19 的嵌合抗原受体修饰的 T 细胞)治疗的研发上,博生吉安科 CD19-CART 自科研临床试验启动以来,已治疗 21 名复发难治性患者。累计入组治疗的19名B-ALL 患者,CR 率为 91.7%;2 名 B-NHL 患者,CR 率为 100%,并预计在 2019 年进行 CAR-T 的临床研究申请。
目前,博生吉安科正在与多家医院合作,开展 CAR-T 临床研究(包括合肥市第一人民医院、合肥市滨湖医院等)。其中,与合肥市第一人民医院血液肿瘤科合作,采用独特的双抗体结构,进行靶向MUC1产品的临床实验效果良好。
该产品以慢病毒负载同时具有抗 Mucin1 及抗 PD-L1 两种 CARs 分子的 NK92 细胞,以 CD28-CD137 作为信号刺激分子,缩短 NK92 细胞上的 PD-1 分子肽链,形成 PD-1/MUC1CAR-pNK92 细胞作为最终效应细胞回输治疗。
公司至今共计纳入了包括肺癌、胰腺癌、结肠癌、卵巢癌在内的 10 例肿瘤患者入组接受治疗,其中 2 例脱组,经过治疗,7 例疾病稳定(SD),1 例疾病进展(PD)。所有受试患者未出现包括细胞因子风暴及骨髓抑制等在内的严重不良反应,有着较好的生物安全性及耐受性。
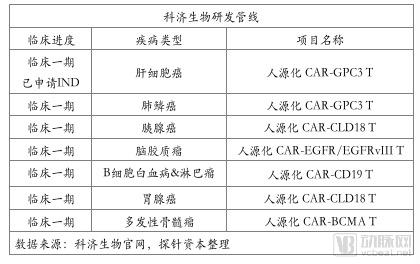
科济生物医药有限公司于2014年10月在上海成立,是一家主要专注实体肿瘤CAR-T细胞疗法临床研发的生物制药公司。2016年1月份,佐力药业全资子公司佐力创新医疗增资8910万元科济生物,持有科济生物 7.85%的股权,布局CAR-T领域。
2015年6月,科济生物开展了全球首个针对肝细胞癌的靶向GPC3靶点的CAR-GPC3 T 临床试验,并在2017年6月于ASCO 2017年会上公布一期临床试验结果。结果表明,13名接受CAR-T细胞治疗的患难治复发的肝细胞癌患者均耐受良好,没有出现剂量限制性毒性(DLT)或3级以上不良反应。
由于GPC3靶点针对肝细胞癌具有高度特异性,脱靶毒性发生的可能性得到有效降低,在临床上表现出良好的耐受性。在Ib/II 期临床试验种,有 5 名可进行疗效评估的患者,1名患者出现部分缓解 (PR), 2 名疾病稳定 (SD) ,2名患者疾病进展(PD)。
除一名疾病进展病人在治疗后 12 月死亡以外,其他 4 名病人都仍然存活,生存期已分别超过 14 个月、20 个月、14 个月和 10 个月。实验结果良好。
2017年12月11日,科济生物已经向上海食药监局递交了CAR-GPC3T细胞制剂用于治疗难治、复发的肝细胞癌的药品注册IND申请,目前已被受理。
2017年5月,科济生物启动针对胃癌、胰腺癌的靶向Claudin18.2 的CAR-T临床试验。Claudin18.2调控细胞膜性质,控制物质交换。之前ASCO会议报道Claudin18.2 抗体 IMAB362 在高表达 Claudin18.2 晚期胃癌患者中,IMAB362 与化疗组合生存期是化疗的两倍(16.7对9个月),效果非常好。
西比曼生物科技集团成立于2009年,并于2014年6月18日在美国纳斯达克挂牌上市,是唯一在美国纳斯达克上市的中国细胞治疗生物医药科技公司。
西比曼通过和中国人民解放军总医院、南京医科大学第一附属医院、GE和赛默飞等战略合作,实现CAR-T领域的研究和布局。其中与中国人民解放军总医院合作研发的靶向CD-19的药物C-CAR011目前正在开展临床Ⅰ期试验,其适应症为r/r B-ALL。与南京医科大学第一附属医院合作研发的靶向CD-19的药物C-CAR011也已进入临床Ⅰ期试验,其适应症为难治性DLBCL。
此外,西比曼与GE 和赛默飞合作,布局建立细胞自动化、工业化生产的GMP实验室。
2018年4月21日,西比曼生物科技集团以“上海赛比曼生物科技有限公司”主体,申报了两项IND:CBM.CD19嵌合抗原受体T细胞注射液治疗r/r B-ALL和难治性DLBCL,目前正在审批中。
除了CD19靶点,西比曼还与中国人民解放军总医院生命科学院分子免疫学研究室主任韩为东教授进行战略合作,进行 CD20 CAR-T研究,治疗复发或难治 B 细胞非霍奇金淋巴瘤,Ⅱa临床试验结果总的客观反应率为 81.8%。2016年8月,其抗 CD20 CAR-NKT 专利获得国家知识产权局授权。
该专利成为国内第一个获得国家专利的 CD20 靶向恶性肿瘤的免疫细胞治疗技术。
西比曼和中国人民解放军总医院 (301医院)合作开展针对 B 淋巴细胞性白血病和恶性淋巴瘤患者的 I 期临床研究,在CART-CD20 靶向性免疫细胞治疗 7 例化疗无效的晚期弥漫性大B淋巴细胞瘤(DLBCL)临床 I 期研究结果显示,在有巨大淋巴肿瘤负荷的患者中,获得高达 75%的有效率(3/4)。这是首次报告 CART-CD20 联合减低瘤负荷治疗方案。
在 CART-CD19 靶向性免疫治疗 9 例成年人、化疗无效、复发的急性 B 系淋巴细胞性白血病的临床 I 期研究结果显示,其总体有效率(ORR)为67.7%。
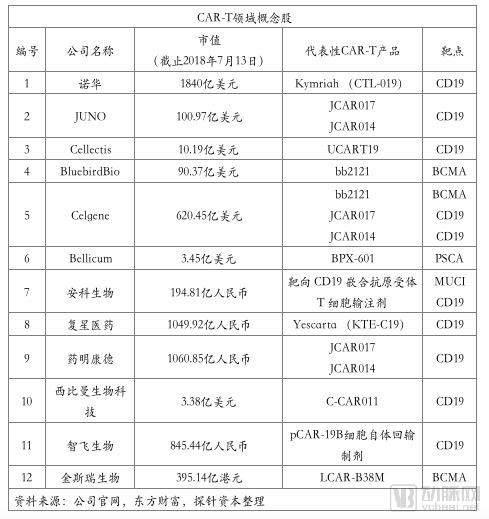
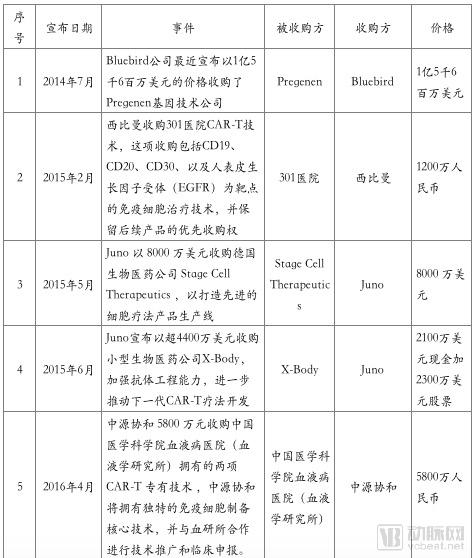
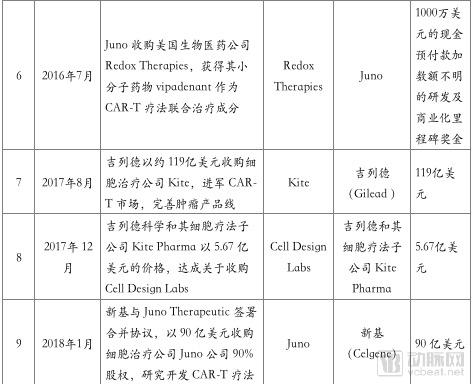
从2017年下半年至今,随着诺华、Kite的CAR-T产品上市, CAR-T产业也强势吸引了众多的资本介入。2017年8月Gilead收购Kite,2018年1月Celgene收购Juno,都为全球CAR-T产业的上升提供了风向标。
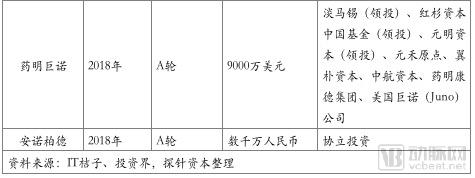
在中国,随着《药品注册管理办法(修订稿)》等政策的颁布,截止2018年7月25日,CDE受理的CAR-T产品IND申报共有24个,涉及公司17家。且随着2017年12月强生3.5亿美元牵手南京传奇LCAR-B38M CAR-T,金斯瑞股票大涨。技术项目的发展与资本进驻的热情让人们看到了中国制造的弯道超车的机会。
CAR-T疗法虽已取得一定进步,但在体内增殖、持续性、肿瘤识别和杀伤能力、克服免疫抑制性微环境、安全性与克服副作用等方面,还需要持续完善。同时,合规性和政策调控也对细胞免疫疗法的发展起到至关重要的影响。
对于细胞免疫疗法来说,因其开发的复杂性,众多国内企业选择与国外知名龙头企业合作开发模式以共担风险。由于CAR-T专利的复杂性、抗体序列和制备工艺的易重叠性,专利问题愈发突出与明显。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。