
# 热门搜索 #
君联医疗全球新药资讯速递 · 第26期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
本周新药数据共8个,其中呼吸2个,皮肤2个,肿瘤、免疫、代谢和疼痛各1个。
❖ PD-1本周在国内迎来高光时刻,施贵宝O药获中国药监局首批用于治疗头颈部鳞癌,至此已累计用于治疗7大癌种,与此同时默沙东K药获批单药用于国内肺癌一线治疗,解锁6大癌种。截至目前,国内已经有5个PD-1单抗批准上市,分别为施贵宝Opdivo、默沙东Keytruda、君实生物的拓益、信达生物的达博舒和恒瑞医药的艾瑞卡。从2019年上半年国内销售数据来看,默沙东Keytruda销售额超10亿元,列居榜首;而施贵宝Opdivo以4.3亿元被K药拉出两倍差距;国产PD-1君实生物的拓益 3.08亿元、信达生物的达博舒3.46亿元,也纷纷交出亮眼答卷;恒瑞艾瑞卡从6月开始加入战局,未来表现值得期待。
❖ 在免疫治疗领域,全球药王修美乐的蛋糕一直是各家关注的香饽饽,IL-17A抑制剂是其有力竞争替代。诺华Cosentyx(苏金单抗)与礼来Taltz作为 IL-17A抑制剂领域的先发者竞争相当激烈。在销售额方面,2019年上半年Taltz的销售额飙升至6.063亿美元,而Cosentyx的表现更加抢眼,同期销售额达到16.5亿美元。在适应症方面,上周诺华宣布Cosentyx在治疗非放射性轴性脊柱关节炎的3期临床试验中达到主要终点,或将迎来第四个适应症。按照Cosentyx强劲的发展势头,未来有可能会进一步侵蚀修美乐的市场。
诺华Cosentyx达到3期临床终点,或将迎来第四项适应症
诺华宣布, Cosentyx在治疗非放射性轴性脊柱关节炎(nr-axSpA)的3期临床试验PREVENT中,达到试验的又一主要终点。
Cosentyx是首个可以直接抑制IL-17A的全人源生物制剂。IL-17A是参与PsA、AS和银屑病的炎症产生及疾病进展的核心致病因子,在发病机制中发挥关键性作用。
为期2年的随机、双盲、含安慰剂对照组的3期临床研究,旨在评估Cosentyx在治疗nr-axSpA患者中的疗效和安全性。试验的主要终点是达到脊柱关节炎国际协会评定40(ASAS40)。
此次宣布的最新数据进一步证明了Cosentyx在治疗强直性脊柱炎(AS)、银屑病关节炎(PsA),以及银屑病中的长期疗效和安全性。
“破发”糖尿病肾病!杨森卡格列净获FDA批准
强生集团旗下的杨森宣布,FDA批准钠-葡萄糖共转运蛋白2抑制剂卡格列净在患有糖尿病肾病和2型糖尿病的成年患者中,用于降低终末期肾病、肾功能下降、心血管死亡以及由于心力衰竭而住院的风险。
卡格列净是一种SGLT2抑制剂,它通过抑制肾小管中表达的SGLT2的功能,减弱肾脏对葡萄糖的重吸收,增加尿液中对葡萄糖的排泄,从而帮助控制2型糖尿病患者的血糖水平。
一项专门检测SGLT2抑制剂对肾功能影响的临床试验。总计4401名处于2或3期慢性肾病的2型糖尿病患者接受了治疗。
在中位随访期2.62年时,卡格列净组患者复合终点风险(包括血清肌酐翻倍,ESKD和肾死亡或心血管死亡)与对照组相比降低了30%,同时卡格列净组患者的主要心血管不良事件(MACE)风险降低了20%。
20年来急性治疗偏头痛首个重大创新!FDA批准礼来5-HT1F受体激动剂上市
礼来(Lilly)公司宣布,美国FDA批准该公司开发的Reyvow(lasmiditan)片剂上市,作为急性疗法治疗有先兆或无先兆成年偏头痛患者。这是20多年来,FDA批准急性治疗偏头痛的第一种新药物类型。
Reyvow是FDA批准的首款血清素(5-HT)1F受体激动剂,是一种创新口服5-HT1F受体激动剂。它能够与5-HT1F受体以高亲和力相结合,不会激活5-HT1B受体,因此不会产生血管收缩效应。
随机双盲,含安慰剂对照的3期临床试验,3177名有偏头痛历史的患者参加临床试验。
与安慰剂组相比,在服药2个小时后患者头痛完全消失的比例显著提高,Reyvow显著消除其它最困扰患者的偏头痛症状(恶心和声光敏感)。在对曲坦类药物反应不足的患者亚群中,也能够产生良好的效果。
BReyvow在3期临床试验中的2h后疗效结果
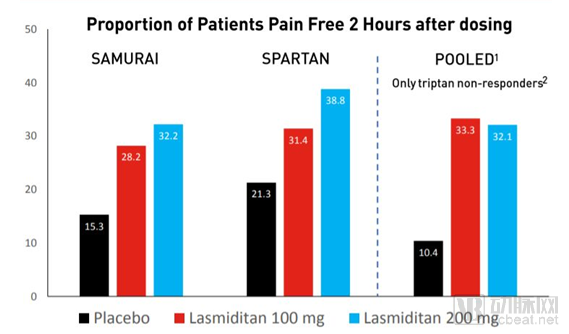
数据来源: 2018 Investment Community Meeting
哮喘患者闻佳音!诺华创新复方疗法达到3期临床终点
诺华(Novartis)公司宣布,该公司开发的复方疗法QVM149,在治疗症状控制不佳的哮喘患者的3期临床试验IRIDIUM中,达到主要临床终点。
QVM149是一款每日一次、固定剂量的复方产品,由长效毒蕈碱拮抗剂(格隆溴铵)、长效β2受体激动剂(茚达特罗)和吸入皮质类固醇(糠酸莫米松)三种有效成分构成。
3092名哮喘控制不佳的成年患者随机接受两种不同剂量的QVM149或QMF149的治疗,都曾接受过中/高稳定剂量的长效β2受体激动剂/皮质类固醇的治疗,但症状仍未得到有效控制。
与活性对照组相比,QVM149不仅显著改善患者的肺功能,还改善了患者的1秒用力呼气量(FEV1),达到了试验的主要终点,但未能达到试验的关键性次要终点。
苦盼二十载!粉刺创新疗法喜获FDA批准
高德美(Galderma)公司宣布,美国FDA批准其视黄酸受体γ(RARγ)激动剂Aklief(trifarotene)软膏上市,治疗9岁及以上寻常痤疮(acne vulgaris)患者。
Aklief是一种选择性视黄酸受体γ激动剂,临床前数据表明,Aklief在角质形成细胞中具有较长的半衰期,但是在肝细胞中的半衰期较短,因此可能在治疗常见皮肤病的同时,具有更好的安全性。
为期12周、随机、双盲的3期试验,主要终点是,在第12周,患者较基线时达到研究者总体评估总分(IGA)2分以上的改善的成功率,面部炎症的改善,以及非炎症病变计数的减少。
Aklief软膏可在两周内显著减少患者的炎症性病变。这两项试验的详细结果已经在Journal of the American Academy of Dermatology期刊上发表。
一线治疗非小细胞肺癌,礼来VEGFR2抑制剂3期结果积极
礼来(Eli Lilly)宣布,其抗血管生成的单抗药物Cyramza(ramucirumab)与罗氏(Roche)的酪氨酸激酶抑制剂(TKIs)Tarceva(erlotinib,厄洛替尼)构成的组合疗法,在一线治疗携带EGFR基因突变的初治转移性非小细胞肺癌(NSCLC)患者的关键性3期试验中获得积极结果。
血管内皮生长因子(VEGF)受体2拮抗剂Cyramza,是一款抗血管生成疗法。Cyramza通过阻断VEGF受体2和VEGF-A,VEGF-C和VEGF-D的特异性结合来阻断该信号通路的激活。
Cyramza的工作机理示意图
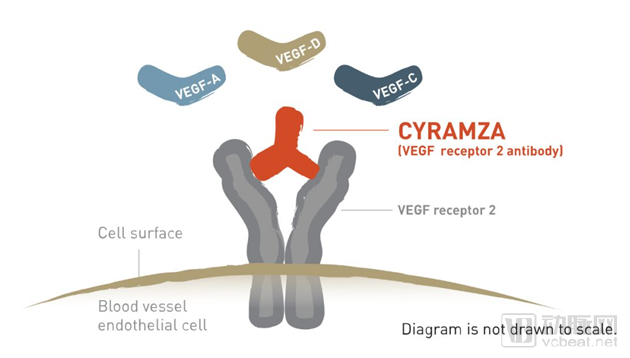
数据来源:Cyramza
449名携带EGFR基因突变的转移性NSCLC患者参与了3期试验,他们被随机分组,分别接受Cyramza与厄洛替尼的组合疗法,或安慰剂与厄洛替尼。主要终点为PFS。
与厄洛替尼组12.4月的PFS相比,组合疗法组的PFS为19.4个月,达到了显著延长PFS这一试验的主要终点。
肺纤维化创新疗法nintedanib获FDA突破性疗法认定,降低肺功能下降速度57%
勃林格殷格翰(Boehringer Ingelheim)公司宣布,美国FDA授予其小分子酪氨酸激酶抑制剂Ofev(nintedanib)突破性疗法认定,用于治疗慢性进行性纤维化间质性肺病(ILD)患者。
Ofev是一种小分子酪氨酸激酶抑制剂,可同时阻断3种生长因子受体,包括血管内皮生长因子受体,血小板源性生长因子受体,以及成纤维细胞生长因子受体,有效抑制纤维化过程中的信号通路。
随机,双盲,含安慰剂对照组的3期临床试验,该试验旨在评估Ofev在治疗进行性纤维化间质性肺病患者中的安全性,耐受性和疗效。
在第52周,通过患者用力肺活量(FVC)的评估,Ofev的治疗使患者的肺功能下降幅度减少了57%,达到试验的主要终点。此外, Ofev在试验中延缓了多种进行性纤维化间质性肺病患者的疾病进展速度。
疗效优于常用疗法,诺华荨麻疹新药临床结果积极
诺华公司宣布,该公司开发的抗IgE人源化单克隆抗体ligelizumab(QGE031),在治疗H1-抗组胺药控制不佳的慢性自发性荨麻疹患者的2b期试验中,与Xolair(omalizumab)相比,显示出更好的疗效。
Ligelizumab是一种作用于IgE(免疫球蛋白E)抗体的单克隆抗体,现处于治疗H1-抗组胺药控制不佳的CSU患者的临床开发阶段。
随机、双盲、含活性对照的2b期临床试验中,382名H1-抗组胺药物控制不佳的CSU患者随机接受三种不同剂量的ligelizumab或Xolair的治疗。
中期数据显示治疗第12周,接受ligelizumab治疗的患者分别有30%(剂量为24 mg),44%(剂量为72 mg)和40%(剂量为240 mg)患者疾病症状得到了完全缓解。而在Xolair治疗组中,这一数值为26%。
❖ 诺华公司宣布FDA批准了该公司的Beovu(brolucizumab)上市,治疗湿性年龄相关性黄斑变性(AMD)。Beovu是一款靶向VEGF的人源化单链抗体可变区片段,与其它靶向VEGF的抗体相比,分子量非常小。它的给药间隔可以达到3个月,为提高湿性AMD患者的生活质量提供了便利。
❖ 默沙东(MSD)公司治疗HIV感染的创新核苷类逆转录酶易位抑制剂(NRTTI)islatravir(曾用名MK-8591),在1期临床试验中获得积极结果。试验结果表明,皮下植入的药物洗脱植入体(drug-eluting implant),能够维持islatravir的长期释放,可保持细胞中药物浓度高于药代动力学阈值长达一年以上。这意味着这款药物可能成为一年只用服用一次的艾滋病暴露前预防(PrEP)疗法。
❖ 美国FDA宣布,批准Clinuvel公司开发的Scenesse(afamelanotide)上市,治疗因为红细胞生成性原卟啉病(erythropoietic protoporphyria)而出现皮肤损伤的成年患者,降低他们曝露在阳光下时可能出现的皮肤疼痛和损伤。FDA的新闻稿表示,这是第一款获批提高这些患者无痛阳光曝露时间的疗法。
❖ 处于临床阶段的生物技术公司Frequency Therapeutics宣布,其旨在促进听力恢复的研究性候选药物FX-322,被FDA授予了快速通道资格,并在治疗感音神经性听力损失(sensorineural hearing loss,SNHL)的2a期实验中,实现首例患者给药。
❖ Nature杂志发表了一项突破成果,来自美国和日本的研究团队在世界上首次利用诱导多能干细胞成功同时培育出了三种互相连接的类器官,包括肝脏、胰腺和胆管。具体来说,研究者们从人类皮肤细胞出发,将它们转换为原始的干细胞,然后引导和刺激这些干细胞形成两个非常早期的细胞“球状体”,随着时间的推移,这些球状体会合并并变为器官,而这些器官最终会变成消化道。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。