
# 热门搜索 #
君联医疗新药速递 2020年第5 期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
本周新药数据共9个,其中肿瘤7个,妇科生殖1个,消化系统1个
❖关于COVID-19,截至2月16日,全国累计确诊70,548例,疑似7,264例,合计77,812例。目前湖北省内外的疫情曲线稍有不同:湖北省内新增确诊病例1,933例,环比增加90例,重症率为16.8%,病亡率2.91%,出院率11.4%;湖北省外新增确诊病例115例,连续13天下降,目前重症率为6.8%,病死率为0.60%,出院率34.0%。综合来看,湖北省内的抗疫局面仍然比较复杂,考虑到确诊病例和重症病例总量庞大,医疗资源仍需重点倾斜,各地也不断抽调精兵强将进行支援;湖北省外的疫情逐步得到了控制,如果新增确诊在接下来的返工潮后1周仍能稳步下降,基本上就可以明确此前的拐点趋势,但仍不能掉以轻心。
❖美国FDA接受诺华提交的MET抑制剂capmatinib的新药申请,以治疗携带MET基因外显子14跳跃突变的晚期NSCLC患者。MET 14外显子跳跃突变在肺腺癌中的发生率约为3%,但在肺肉瘤样癌中的发生率高达22%,目前全球尚没有高选的MET抑制剂上市,主要是用克唑替尼(c-Met和ALK融合)治疗,但疗效不是非常良好。Capmatinib是Incyte在2009年授权给诺华的药物,根据协议,若该药物达到各项终点,Incyte有资格获得超过5亿美元的里程碑付款以及诺华在全球销售的特许权使用费。作为主要竞争者,Merck的tepotinib也在2期临床,国内主要是正大天晴和广安堂在跟进。
Epizyme宣布美国FDA已接受其开发的EZH2抑制剂提交的补充新药申请,用于治疗复发难治性滤泡性淋巴瘤患者
Epizyme宣布美国FDA已接受其开发的EZH2抑制剂Tazverik提交的补充新药申请,用于治疗复发或难治性滤泡性淋巴瘤(FL)患者
Tazverik是一款蛋白赖氨酸甲基转移酶(Histone-Lysine N-methyltransferase)EZH2抑制剂,通过抑制EZH2的活性,能够让B细胞继续分化或者产生细胞凋亡,从而控制肿瘤的生长
在2期单臂试验中,携带野生型EZH2基因或突变型EZH2基因的FL患者接受了Tazverik的单药治疗。
Tazverik的治疗使携带EZH2突变的患者达到69%的ORR,在野生型EZH2患者亚组中的这一数值为35%。突变型EZH2患者的中位PFS为14个月,野生型为11个月
FDA批准Braintree Laboratories开发的口服乳糖醇疗法Pizensy上市,治疗慢性特发性便秘成人患者
美国FDA批准Braintree Laboratories开发的口服乳糖醇疗法Pizensy(lactitol)上市,治疗慢性特发性便秘(CIC)成人患者
Pizensy是一种口服的乳果糖类似物。它是一种渗透性泻药(osmotic laxitaive),可促进水分流入肠道,进而在结肠内达到通便作用
在807名CIC患者的临床试验中,使用患者较基线时完全自发排便(CSBMs)的分析结果作为终点评估Pizensy的疗效
与安慰剂组相比,Pizensy治疗组中25%的患者在给定的一周内至少达到了3次CSBMs,或较基线时至少增加1次CSBMs,而安慰剂组中达到这一标准的患者比例为13%。
Seattle Genetics宣布FDA已接受其HER2 TKI的NDA,用于与曲妥珠单抗和卡培他滨联用,治疗晚期乳腺癌
Seattle Genetics宣布FDA已接受其HER2 TKI的新药申请(NDA),用于与曲妥珠单抗和卡培他滨联用,治疗不可切除的局部晚期或转移性HER2阳性乳腺癌患者
Tucatinib是一种口服的酪氨酸激酶抑制剂,对HER2具有高选择性,但对同属人表皮生长因子受体家族的EGFR没有明显抑制作用
在3期试验中,tucatinib联合曲妥珠单抗和卡培他滨,与曲妥珠单抗和卡培他滨联用相比,在治疗局部晚期不可切除或转移性HER2阳性乳腺癌患者中的疗效与安全性,其中47%患者携带脑转移瘤。
实验组显著提高患者的PFS,与将患者的疾病进展或死亡风险降低46%,此外还改善了患者的OS,将患者死亡风险降低了34%。在携带脑转移瘤亚组中,实验组将疾病进展或死亡风险降低52%
Tucatinib的临床结果(PFS)
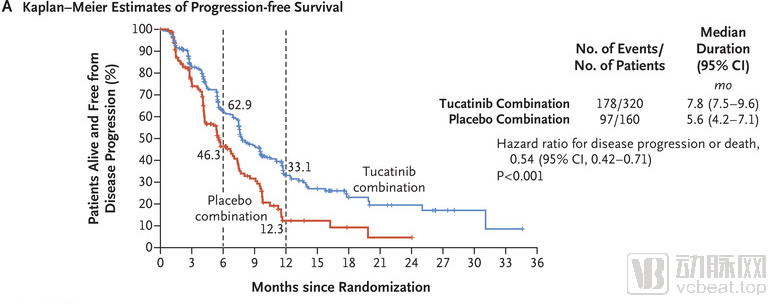
数据来源:NEJM
Deciphera宣布FDA已接受其KIT和PDGFRα激酶抑制剂ripretinib的NDA,用于末线治疗晚期胃肠道间质瘤患者
Deciphera宣布FDA已接受其KIT和PDGFRα激酶抑制剂ripretinib的NDA,用于治疗已接受过imatinib,sunitinib和regorafenib治疗的晚期胃肠道间质瘤(GIST)患者
Ripretinib是一种KIT或PDGFRα激酶抑制剂,用于治疗KIT或PDGFRα驱动的相关癌症,包括GIST,系统性肥大细胞增多症(SM)等其它癌症
在3期试验中,129名患者按照2:1的比例分别接受ripretinib或安慰剂的治疗,旨在评估ripretinib对于先前已接受过imatinib、sunitinib和regorafenib治疗的晚期GIST患者中的疗效。
ripretinib达到了改善患者PFS和OS的主要终点,治疗组中患者的PFS为27.6周,而安慰剂组仅为4.1周。治疗组中患者的OS为15.1个月,而安慰剂组仅为6.6个月,达到了临床意义上的显著改善
BMS宣布美国FDA已接受其CAR-T疗法的BLA,治疗复发/难治的大B细胞淋巴瘤患者,包括DLBCL
BMS宣布美国FDA已接受其CAR-T疗法lisocabtagene maraleucel(liso-cel)的BLA,治疗复发/难治的大B细胞淋巴瘤患者,包括DLBCL
Liso-cel是一款靶向CD19抗原的自体CAR-T疗法,这款疗法的独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制,从而可以更好地控制细胞疗法的毒副作用
在名为TRANSCEND NHL 001临床试验中,256名患者参与了实验,这是目前支持靶向CD19抗原CAR-T疗法的最大型研究
患者的ORR达到73%,其中53%的患者达到CR
Seattle Genetics宣布其ADC药物Padcev与免疫疗法combo在治疗晚期尿路上皮癌患者2期研究中数据积极
Seattle Genetics宣布其ADC药物Padcev与免疫疗法pembrolizumab联合作为一线疗法,在治疗晚期尿路上皮癌患者2期研究中,数据积极
Padcev是一款将抗Nectin-4单克隆抗体与微管破坏剂MMAE连接起来生成的抗体偶联药物(ADC)
在名为EV-103的1b/2期临床研究中,Padcev与pembrolizumab联合治疗无法接受一线基于顺铂化疗的晚期或转移性尿路上皮癌患者
在中位随访时间为11.5个月时,该联合疗法使患者的ORR达到73%。其中,CR比例为15.6%,部分缓解的患者比例为57.8%
Myovant Sciences宣布其在研relugolix组合疗法,在治疗子宫肌瘤患者的3期拓展临床研究中,达到主要疗效终点
Myovant Sciences宣布其在研relugolix组合疗法,在治疗子宫肌瘤患者的3期拓展临床研究LIBERTY中,达到主要疗效终点
Relugolix组合疗法每片包含relugolix(40 mg),雌二醇(1.0 mg),以及醋酸炔诺酮(0.5 mg)
3期拓展临床研究
relugolix组合疗法可以在保持患者骨矿物质密度的同时,使患者在一年内达到87.7%的缓解率(缓解标准为月经出血量小于80毫升,或者与基线相比,月经出血量在最后35天的治疗周期中减少超过50%)
Kite宣布美国FDA已接受其CAR-T疗法KTE-X19的BLA,治疗复发/难治型套细胞淋巴瘤(MCL)患者
Kite宣布美国FDA已接受其CAR-T疗法KTE-X19的BLA,治疗复发/难治型套细胞淋巴瘤(MCL)患者,如果获得批准,Kite公司将成为首家拥有多款商业化CAR-T疗法的公司
KTE-X19是一款靶向CD19的自体CAR-T疗法。它使用了包含T细胞筛选和淋巴细胞富集的XLP制造工艺
在2期临床研究中,60名参加该试验的MCL患者已经接受过5种前期治疗,包括化疗,抗CD20单克隆抗体疗法,BTK抑制剂ibrutinib或acalabrutinib,但患者产生耐药性或疾病复发
患者疾病的ORR达到93%,其中67%达到CR。在中位随访时间为12.3个月时,57%的患者缓解仍然得到维持。在最初接受治疗的28名患者(随访时间至少为24个月)中,43%的患者仍然活着
诺华宣布美国FDA已接受其MET抑制剂capmatinib的NDA,以治疗MET外显子14跳跃突变的晚期NSCLC患者
诺华宣布,美国FDA已接受其MET抑制剂capmatinib(INC280)的新药申请(NDA),以治疗携带MET基因外显子14跳跃突变的晚期NSCLC患者
Capmatinib是一种口服的高选择性小分子MET抑制剂,最初由Incyte发现,诺华在2009年获得它的研发和推广许可。此前,FDA曾授予capmatinib突破性疗法认定
2期临床试验招募了97名带有MET外显子14跳跃突变的晚期或转移性NSCLC患者
在初治患者和经治患者中,capmatinib的总缓解率分别为67.9%和40.6%。两组患者的中位缓解持续时间分别是11.14个月和9.72个月
Camatinib的酶学特征
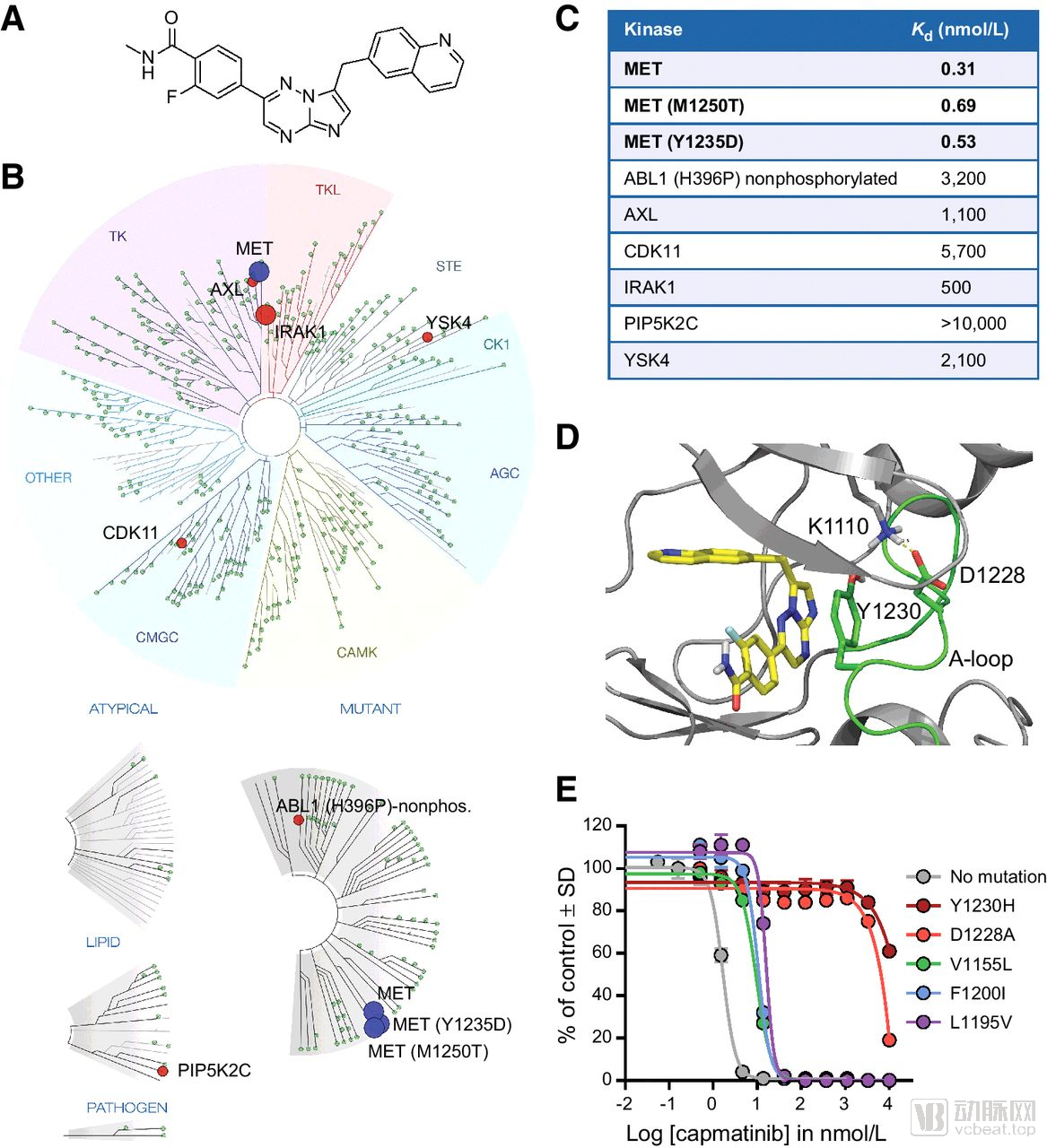 数据来源:novartis
数据来源:novartis
❖ 关于COVID-19,截至2月16日,国内现有确诊病例57,934例(其中重症病例10,644例),累计治愈出院病例10,844例,累计死亡病例1,770例,累计报告确诊病例70,548例,现有疑似病例7,264例
❖ 阿斯利康公布2019年财报,总收入243.84亿美元,同比增长10%。其中中国区收入48.80亿美元,同比增长35%,占到阿斯利康全球总收入的20.7%。阿斯利康已经成为在中国市场业绩表现最好的外资药企,并且还将继续创下新高
❖ 罗氏公布了2019年财报,总收入614.66亿瑞士法郎,同比增长8%。其中制药业务收入485.16亿瑞士法郎(+10%),诊断业务收入129.50亿瑞士法郎(+1%)。中国区收入达到31亿瑞士法郎,增长36%。
❖ Dendreon Pharmaceuticals公布了首个现实世界研究数据,数据显示根据对6000多名Medicare付费医疗保险受益人医疗和药房索赔数据的回顾性分析,在患者mCRPC治疗方案中的任何时候,在Zytiga®(醋酸阿比特龙)或Xtandi®(恩扎卢胺)中添加Provenge,将死亡风险降低了45%,OS延长了14.5个月
❖ 强生旗下杨森制药公布了抗炎药Stelara(喜达诺,乌司奴单抗)治疗克罗恩病IIIb期STARDUST研究的中期数据。数据显示:接受Stelara一剂6mg/kg IV输注和一剂90mg SC注射治疗后,在第16周,有79%的患者达到临床应答、有67%的患者处于临床缓解
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。