 2019.6.24-2019.6.30,本周新药数据共13个,其中肿瘤4个,基因治疗等创新疗法3个,代谢疾病2个,罕见病、炎症、精神病和心脏病各1个。
2019.6.24-2019.6.30,本周新药数据共13个,其中肿瘤4个,基因治疗等创新疗法3个,代谢疾病2个,罕见病、炎症、精神病和心脏病各1个。
❖本周又一重磅NASH药物临床遭遇失败。诺华NASH新药Emricasan临床2b期试验未能显示出PFS的改善,试验已经暂停。2019年我们见证了Intercept奥贝胆酸的成功,见证了吉利德Selonsertib在两个3期研究中的失败。艾尔建和Genfit也预计在今年晚些时候公布关键3期数据。NASH领域存在未被满足的巨大医疗需求,所以一直吸引着各公司进入,但从目前看确实风险也比较高。
❖O药又一次折戟,本周BMS公布了Opdivo一线治疗肝细胞癌HCC的3期临床研究CheckMate-459的顶线数据,结果显示在OS数据上O药并未能显著差异于索拉非尼。此前默沙东在ASCO大会上公布了Keynote-240研究结果,K药同样在HCC的治疗中未能取得OS/PFS的优势。目前看来在消化道领域(肝癌、胰腺癌、胃癌等),免疫单药挑战标准疗法较为困难,未来可能还需要做更多工作以实现突破。
❖阿斯利康公司开发的PD-L1抗体Imfinzi本周公布了治疗广泛性小细胞肺癌的积极3期数据,Imfinzi+依托泊苷+铂基化疗的方案取得了显著OS改善。SCLC的药物研发进展一直较NSCLC稍慢,Imfinzi此次的成功为患者提供了更多的选择,也让已经是重磅药物的I药更受期待。
阿斯利康PD-L1抑制剂Imfinzi
治疗小细胞肺癌到达3期终点
阿斯利康宣布旗下PD-L1抑制剂Imfinzi在一线治疗广泛期小细胞肺癌的3期临床试验中达到主要终点,显著提高患者总生存期。该临床试验的成功使得Imfinzi有望成为继Tecentriq之后第二个获批小细胞肺癌的PD-L1抑制剂。
Imfinzi是一款PD-L1抑制剂。
该批准主要基于名为CASPIAN的开放标签、随机、全球性3期临床试验。
试验数据显示,Imfinzi+依托泊苷+铂基化疗,与标准化疗相比显著提升了患者的OS,试验达到了临床终点。
O药一线治疗肝细胞癌失败
BMS 公布了Opdivo一线治疗肝细胞癌的3期临床研究CheckMate-459的顶线数据,数据显示O药未能达到OS这一主要终点。
名为CheckMate-459的3期临床试验。
O药在OS这一指标上未取得统计学意义的显著改善,但有一定改善趋势。
FDA批准杨森Darzalex创新组合疗法
一线治疗多发性骨髓瘤
FDA宣布批准杨森和Genmab联合开发的Darzalex(daratumumab),与来那度胺和地塞米松联用,治疗不适用自体干细胞移植疗法的初治多发性骨髓瘤患者。
Darzalex是全球获批的首个CD38介导性、溶细胞性单抗药物
获批基于纳入了737名患者的、名为MAIA的开放标签,随机3期临床试验。
与标准化疗相比,Darzalex组合将患者疾病进展或死亡风险降低44%。并且患者的完全缓解率(48% VS 25%),部分缓解率(79% VS 53%)和总缓解率(93% VS 81%)都得到显著提高。
GSK的PARP抑制剂Zejula
递交治疗乳腺癌sNDA
GSK宣布FDA接受了PARP抑制剂Zejula(niraparib)递交的sNDA,并且授予其优先审评资格。Zejula有望治疗接受过3种以上前期疗法的卵巢癌患者。
Zejula是一款PARP抑制剂。
此次sNDA基于名为QUADRA的开放标签、单臂、2期临床试验。
Zejula不仅在携带BRCA基因突变的患者中产生疗效(ORR为29%),在不携带BRCA基因突变、但具备同源重组缺陷的患者中也产生了明显疗效(ORR为15%)。
图 PARP的作用机制
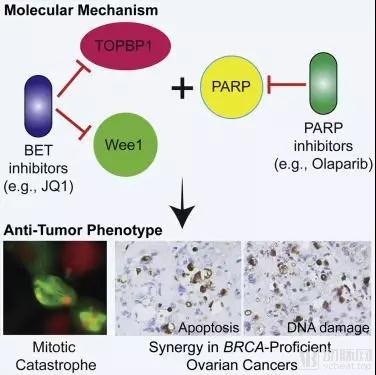
数据来源:science direct
FDA批准补体抑制剂治疗视神经脊髓炎谱系疾病
Alexion Pharmaceuticals公司开发的补体抑制剂Soliris(eculizumab)获FDA批准扩展适应症,治疗治疗视神经脊髓炎谱系疾病患者。
Soliris是Alexion公司研发的C5补体抑制剂,通过抑制补体级联反应终端的C5蛋白来降低炎症反应。
此次批准基于一项48周、纳入143名患者的临床试验。
与安慰剂对照组相比,Soliris能够将患者复发次数降低94%。
FDA批准首款鼻窦炎生物制剂疗法
赛诺菲和再生元联合开发的药物Dupixent(dupilumab)近日获FDA批准扩展适应症,用于治疗伴有鼻息肉的慢性鼻窦炎成人患者。
Dupixent是抑制IL-4/IL-13信号通路的全人源化单克隆抗体。
批准基于两项关键性临床试验SINUS-24和SINUS-52。
试验数据显示,接受治疗的患者鼻充血/鼻阻塞的严重程度分别降低了57%(SINUS-24)和51%(SINUS-52),对照组分别降低了19%和15%。Dupixent治疗组的鼻息肉指数分别降低了33%和27%,同时对照组反而上升了7%和4%。
礼来治疗心力衰竭SGLT2
抑制剂获FDA快速通道资格
礼来与BI联合研发的empagliflozin近日被FDA授予快速通道资格,用于治疗慢性心力衰竭患者。
Empagliflozin是礼来和BI联合开发的SGLT2抑制剂。
目前正在进行的主要是两项3期随机双盲临床试验,超过9000名慢性心力衰竭的成年患者接受了治疗。
试验正在进行中。
科济生物宣布其BCMA CAR-T疗法IND获批
科济生物自研BCMA CAR-T疗法 CT053近日获得FDA的IND批准,成为国内原研CAR-T项目首个独立在美国获得IND的项目。
该疗法是科济生物自主研发的,采用全人抗体靶向BCMA的CAR-T疗法。
临床试验尚未开展。
临床试验尚未开展。
Krystal Biotech基因疗法
在2期临床实验中取得积极结果
Krystal Biotech公司宣布,旗下基因疗法KB103在治疗营养不良性大疱性表皮松解症的2期临床试验中取得积极结果。该疗法同时获得了FDA授予的再生医学先进疗法(RMAT)认定。
KB103是一种使用复制缺陷型、非整合型病毒载体的基因疗法。
KB103的2期临床试验GEM-2。
试验数据显示,6名皮肤受伤患者中的5名,在接受KB103治疗后达到100%伤口闭合。
Alnylam口服siRNA药物可达到皮下注射相同效果
Alnylam宣布其创新药物平台可使siRNA口服配方能够达到与皮下注射配方相同的效果。
Baxdela是一款创新广谱抗生素,对革兰氏阴性和阳性菌都具有效力,并可治疗耐甲氧西林金黄色葡萄球菌。
研究人员通过将N-乙酰化半乳糖胺(GalNAc)缀合的siRNA与一种渗透增强剂组成组成口服配方。
试验结果显示,口服配方能够持续在小鼠肝脏中敲低基因表达40多天。
Minerva Neurosciences失眠症新药
在2期实验中取得积极结果
Minerva Neurosciences与杨森公司联合开发的seltorexant(MIN-202)在治疗失眠患者的2b期临床试验中,达到试验的主要和关键性次要终点。
Seltorexant是一种的食欲素-2受体特异性拮抗剂。
随机双盲、含安慰剂对照和活性对照的多中心2b期临床试验。
试验结果表明,Seltorexant可以显著降低第一晚达到持久睡眠所需时间(50分钟 VS 15分钟)。
诺华NASH新药Emricasan 2期临床失败
诺华与合作伙伴Conatus制药联合宣布, Emricasan治疗NASH的2b期研究ENCORE-LF没有达到主要终点。
Emricasan是一种具有口服活性的泛caspase蛋白酶抑制剂。
2b期研究ENCORE-LF在失代偿NASH肝硬化患者中开展。
试验结果显示,与安慰剂组相比,Emricasan治疗组无事件生存未表现出显著改善。
图:Emricasan机制
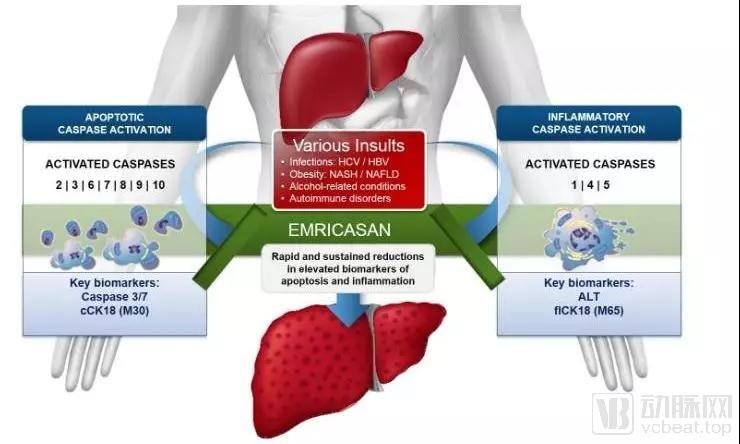
来源:Conatus官网
礼来2型糖尿病疗法Trulicity
在3期临床中达到主要终点
礼来开发的糖尿病疗法Trulicity(dulaglutide)在治疗2型糖尿病的3期临床试验中达到主要终点。
Trulicity是一款每周注射一次的GLP-1受体激动剂。
名为AWARD-11的随机、双盲3期临床试验中,1842名2型糖尿病患者接受了治疗。
在接受治疗36周之后,AWARD-11试验在降低A1C水平和体重上达到了临床终点。

❖Abbvie和Allergan宣布,两家公司签订最终交易协议,AbbVie将以价值630亿美金的现金/股票收购Allergan。本交易预计将于2020年初完成。
❖致力于开发治疗遗传疾病创新疗法的BridgeBio Pharma公司正式在纳斯达克上市,其IPO融资规模高达3.48亿美元,创下今年生物医药基地公司IPO募资记录。BridgeBio研发管线中有16个研发项目,其中3个已经处于3期临床试验阶段。
❖GENFIT宣布公司与Terns Pharmaceuticals达成研发许可和合作协议。Terns将获得GENFIT的主打在研产品PPARα/PPARδ双重激动剂elafibranor在大中华区的开发和推广权益,用以治疗NASH和PBC。GENFIT将获得3500万美元的前期付款,和潜在的1.93亿美元的里程碑付款。
❖博雅生物拟以发行股份和可转换公司债券及支付现金的方式收购罗益生物60.55%股权。罗益生物主要从事疫苗的研发、生产和销售,主要产品包括A群C群脑膜炎球菌多糖结合疫苗和双价肾综合征出血热灭活疫苗。
❖复星医药子公司拟7.47亿元收购力思特制药,力思特产品以抗胆碱药物为主。



 2019.6.24-2019.6.30,本周新药数据共13个,其中肿瘤4个,基因治疗等创新疗法3个,代谢疾病2个,罕见病、炎症、精神病和心脏病各1个。
2019.6.24-2019.6.30,本周新药数据共13个,其中肿瘤4个,基因治疗等创新疗法3个,代谢疾病2个,罕见病、炎症、精神病和心脏病各1个。




























