
# 热门搜索 #
Dynacure:获5000万欧元C轮融资,专注孤儿病领域,挑战中央核性肌病(CNM)【海外案例】
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
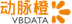 提供支持
提供支持近日,动脉网获悉,法国药物开发公司Dynacure完成了5000万欧元的C轮融资。本轮融资由Perceptive Advisors牵头,包括新投资者Bpifrance Large Venture和Tekla Capital Management,以及现有投资者Andera Partners、Kurma Partners和Pontifax等的参与。
此轮融资资金将用以支持其正在进行的DYN101计划——在中央核性肌病患者中的1/2期Unite-CNM研究。
Dynacure 既往融资历史
近年来,随着各国陆续推出孤儿病相关药物研发的新优惠政策以惠及孤儿病患者,孤儿病药物研发的良好前景吸引了一大批老牌制药企业和新创药物开发公司进行孤儿病药物的研究。Dynacure就是众多新创企业之一。
Dynacure成立于2016年,是法国IGBMC(遗传、分子和细胞生物学研究所)的衍生公司。其总部位于法国的斯特拉斯堡,在美国宾夕法尼亚州费城设有公司的办事处。Dynacure是一家临床阶段的药物开发公司,致力于改善孤儿病(Orphan Disease)患者的生活。
“孤儿病”即罕见病,是一类发病率极低的疾病。孤儿病的用药又称为孤儿药(Orphan Drug)。虽然世界各国根据国情对孤儿病的认定标准存在一定差异,但普遍共识为成人患病率低于五十万分之一、新生儿中发病率低于万分之一的疾病。基于该定义估算,全球范围内,罕见病患者总数已达到3亿人。中国罕见病患病人数约2000万,且每年新增患者超过20万。
Dynacure公司团队利用其在孤儿病药物研发方面的优势来建立新药开发渠道。2017年,Dynacure与专注研究RNA靶向药物领域多年的美国制药公司Ionis Pharmaceuticals合作,共同开发项目计划DYN101。
Stephane van Rooijen是Dynacure的首席执行官,他在欧洲和北美组织的生命科学领域拥有丰富的经验。Stephane曾在鲁汶大学学习医学,获得医学博士学位,又在鹿特丹伊拉斯姆斯大学和华盛顿特区乔治敦大学进行工商管理专业的学习,获得了MBA学位。

Dynacure CEO:Stephane van Rooijen
图片来源:Dynacure官网
Stephane最初在Arthur D. Little的战略顾问团队开始了他的职业生涯。他加入Genzyme Corporation从事业务发展和金融方面的工作后,成为了欧洲心血管业务部门总负责人。在那里,他管理跨职能业务部门团队和早、后期投资组合,推出新产品并管理损益表。
2012年,Stephane加入Viropharma,负责领导该公司的主要商业计划Cinryze(用于遗传性血管水肿的孤儿药)。2014年,他又作为Confo Therapeutics(VIB-VUB衍生公司)的创始人兼首席执行官,成立公司、筹集资金、招募团队,领导了公司的业务扩展以建立药物开发计划的投资组合。
作为一家专注于孤儿病药物领域的药物开发公司,Dynacure在其主打药物开发项目DYN101中,将重点放在了中央核性肌病(Centronuclear and myotubular myopathies, 简称CNM)上。
中央核性肌病(CNM)基于肌肉活检的异常发现——受累肌纤维核位于中央而得名。该病由MTM1、DNM2和BIN1等多种基因突变所驱动。Dynacure公司的研究人员发现,DNM2的升高与该病的直接病因相关。CNM有多种遗传形式,包括X染色体隐性遗传(XLCNM/肌小管肌病)、常染色体显性遗传(ADCNM)和常染色体隐性遗传(ARCNM),并都与预后不良有关。
中央核性肌病(CNM)是从出生起就会影响患者骨骼肌生长的罕见且威胁生命的遗传性疾病。其影响程度有重有轻,症状从出生持续到成年后期。这种疾病会严重影响患者的生活与工作:患者呼吸肌无力需要靠通气辅助;腿部肌无力会影响其行走,随着病情的加重会需要使用轮椅;食道肌无力导致吞咽困难,需要依赖胃管以确保患者获得所需能量等。这些患者急需有效的治疗来缓解疾病,提高生活质量。
DYN101是一种反义寡核苷酸(ASO)疗法,旨在调节动力蛋白2(DNM2)的表达以治疗CNM。该项目与美国制药公司Ionis Pharmaceuticals进行合作,使用Ionis的创新反义平台共同开发。
Dynacure开发的先导化合物使用反义分子靶向Dynamin-2基因。当细胞想发送RNA信息以构建蛋白质时,反义分子与RNA结合,阻断指定的碱基对,也就在一定程度上阻断了相关蛋白质的表达,最终改变产生的蛋白质或显著降低产生的蛋白质量。
临床前研究表明,DYN101具有在CNM中改变疾病的潜力,在治疗XLCNM和ADCNM的动物模型方面具有显著的临床前功效,在改善小鼠全身力量和生存期方面呈明显的剂量依赖性。
首席执行官Stephane van Rooijen在2018年对《端点新闻》(Endpoints News)表示:“我们的动物数据表明Dyn101能够阻止疾病进展和逆转疾病。”
Dynacure团队认为,鉴于有效的反义药物具有调节其他罕见疾病中难于控制的生物靶标的能力,反义技术是治疗CNM的最佳作用机制。Dynacure已经证明,DYN101下调了dynamin 2基因的表达,使得相关小鼠模型中疾病得到控制和病情发生逆转。小鼠模型表明,dynamin蛋白减少50%就可以有效缓解疾病。
Dynacure的DYN101开发计划是针对大多数CNM人群、XLMCM、ADCNM和ARCNM进行的唯一已知项目。该项目还被设计得非常广泛,Dynacure除了研究DYN101用于治疗CNM外,还想扩大DYN101的使用范围。
Dynacure首席开发官Leen Thielemans说:“DYN101有望对患者产生重大影响,我们相信此药有望治疗中央核性肌病。并且,在我们准备开始UNITE-CNM临床研究前,我们打算扩大DYN101的使用,以探索DNM2过表达为疾病驱动因素的其他适应症。”
目前,Dynacure研究的DYN101已经获得了美国食品药品监督管理局(FDA)和欧洲药物管理局(EMA)授予的孤儿药资格认定。
几十年前,由于孤儿病患者的数量非常稀少,治疗孤儿病的相关药物研发费用却极其高昂,制药企业和生物科技公司一直不能满足孤儿病患者的需求。如今,在各国相关政策的扶持下,这种局面有了很大改观。
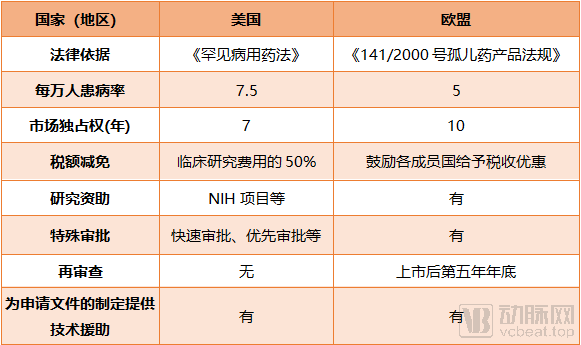
在美国,孤儿药法案实施前(1983年前),FDA批准的所有新药中总共只有38种用来治疗罕见病。孤儿药法案通过后,1983—2018年期间,FDA批准上市的孤儿药达770个,给予资格约4860个。在2019年FDA批准的49款创新药中,用于治疗孤儿病的药物占了44%,而2020年至今已批准的11款创新药中有5款是孤儿药。
美国FDA开启孤儿药资格认定,为孤儿病研究市场提供了重要的开发激励措施,比如相关药物获批后7年的市场独占权、临床试验费用相关的税收抵免、FDA用户费用的免除以及得到FDA在临床试验设计方面的帮助等。
由欧洲药物管理局(EMA)批准的具有“孤儿药标识”的产品将有资格在欧盟获得长达十年的市场独占权、有资格获得协议帮助,还可以使用欧盟的集中式营销授权程序。
美国、欧盟对于孤儿病药物审批的相关优惠措施
这些政府的相关举措和出台法案对孤儿病药物的研发产生了显著的影响。近年来,罕见病用药研发已成为新药研发的主战场。
2018年全球罕见病用药市场规模为1310 亿美元,并以12.3%的年复合增长率快速增长,预计到2024年,罕见病用药市场规模将达到2420亿美元。罕见病用药市场增速是同时期非罕见病用药市场增速(6%)的两倍,预计到2024年,罕见病用药在处方药市场中的占比将初次突破20%。
2019年4月,Dynacure获得CTA批准,开始进行DYN101的第1/2期研究“Unite-CNM”。Unite-CNM(DYN101-C101)是一项欧洲多中心、递增剂量研究,旨在评估DYN101在约16岁以上XLCNM或ADCNM患者中的安全性、耐受性、药代动力学和初步疗效。
虽然1/2期研究的重点是在治疗12周后通过安全性、耐受性等目标来寻找最佳剂量的药物,但Dynacure还在探索分析DYN101的多个功效领域。
目前,在“ Unite-CNM”的1/2期研究中,Dynacure宣布已有首位CNM患者使用DYN101。首位患者用药一个月后,2020年4月2日,Dynacure宣布获得了C轮融资,以继续推进该试验。
长时间以来,中国没有建立罕见病种类的统计数据和病种目录,也无明确的罕见病用药定义,所以在罕见病领域药物的注册生产上并未有快速发展。自2018年起,我国陆续出台相关政策支持罕见病用药的研发,加速了相关药物的研究进程。
2018年5月,国家卫生健康委、科技部、工信部等五部门联合印发了《第1批罕见病目录》,121种疾病被列入罕见病目录,加强国家对罕见病的管理;2019年2月,国家决定对头批21个罕见病药品和4个原料药实行降税优惠。
如今,我国政府已出台了罕见病药物领域降低罕见病用药进口关税、加速罕见病用药审评审批、将罕见病用药纳入医保等政策。多项政策的落实,极大地改善了罕见病患者“病无所医、医无所药、药无所保”的窘境,鼓舞了国内药企的信心,促使了更多药企加大对罕见药的研发投入。
目前,我国已诞生了北海康成、应诺医药、北京科信必成等罕见病用药研发企业。其中,北海康成建立了中国罕见病药物研发与商业一体化平台,通过引进国外技术、自主创新等方式推动了罕见病用药在中国上市。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。