
# 热门搜索 #
君联医疗新药速递 2020年第 12 期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
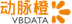 提供支持
提供支持
本周新药数据共8个,其中肿瘤2个,血液2个,心血管、代谢、ENT和移植1个。
❖美国FDA批准由法国公司LFB Biotechnology开发的Sevenfact上市,用于治疗和控制成人血友病患者的出血事件。重组活化凝血七因子(FVIIa)是极具难度的领域,Sevenfact是近20年来第2个新药,第1个是诺和诺德1999年获批的NovoSeven(诺其)。Sevenfact从转基因兔的乳汁中提取而得,在2017年1月就已提交BLA,但直到三年后才被批准,这也说明FVIIa开发难度极大。百特、CSL、OPKO、CMC、康宁杰瑞、泽璟生物等都有进行过FVIIa研发,但因结构和翻译后修饰的复杂性在不同阶段放弃。不过如果不能直捣黄龙,曲线救国其实也是一个方法。罗氏的Hemlibra属于双特异性抗体,同时靶向凝血因子IXa和X,替代凝血因子Ⅷ,介导凝血因子X形成凝血因子Xa,所以疗效显著优于NovoSeven,这也给血液疾病的治疗提供了新的思路。
❖2020年第一季度,FDA共批准11个新药上市,其中比较有代表性的是以下3个:(1)Blueprint Medicines的Ayvakit ,用于治疗血小板源性生长因子受体 α(PDGFRA)基因18外显子突变的成人胃肠道间质瘤GIST患者;(2)Esperion公司的Nexletol,用于辅助他汀治疗成人杂合子型家族性高胆固醇血症(HeFH)患者,或者用于需要进一步降低LDL-C的动脉粥样硬化性心血管疾病(ASCVD)患者;(3)赛诺菲的CD38单抗药物Sarclisa ,用于联合泊马度胺和地塞米松治疗既往至少接受过2线以上疗法(包括来那度胺和一种蛋白酶体抑制剂)的复发性难治性多发性骨髓瘤(MM)成人患者。
阿斯利康(AstraZeneca)宣布,其PD-L1抑制剂Imfinzi(durvalumab)获得美国FDA批准,与依托泊苷加卡铂或顺铂联用,一线治疗广泛期小细胞肺癌(ES-SCLC)成人患者
Imfinzi是一款人源化抗PD-L1单克隆抗体,它通过防止PD-L1与PD-1和CD80受体的结合,解除免疫抑制,增强人体免疫系统对抗癌症的能力
在名为CASPIAN的开放标签、随机、全球性3期临床试验中,广泛期SCLC患者接受了基于Imfinzi的组合疗法或者标准化疗组合的治疗。
在Imfinzi组合疗法组中,患者死亡风险降低了27%(HR=0.73;95% CI 0.59-0.91;p=0.0047),中位OS为13.0个月,而化疗对照组为10.3个月。结果还显示,Imfinzi组合疗法组患者确认的客观缓解率(68%)与对照组(58%)相比有所增加。
再生元(Regeneron)公司公布了该公司开发的evinacumab,在治疗纯合子家族性高胆固醇血症(HoFH)患者的3期临床试验详细结果
Evinacumab是一种针对ANGPTL3的单克隆抗体。ANGPTL3是脂蛋白脂肪酶和内皮脂肪酶抑制剂,在脂蛋白新陈代谢中具有重要作用
在名为ELIPSE的3期临床试验中,HoFH患者在接受其它降脂疗法之外,接受evinacumab或安慰剂的治疗。这些患者中95%使用了他汀类药物,79%使用了PCSK9抑制剂。
在接受治疗24周之后,evinacumab治疗组LDL-C与对照组相比,降低49%(p<0.0001)。47%的患者LDL-C水平降至100 mg/dL以下,而对照组的这一数值为23%。
Evinacumab的工作原理
数据来源:regeneron
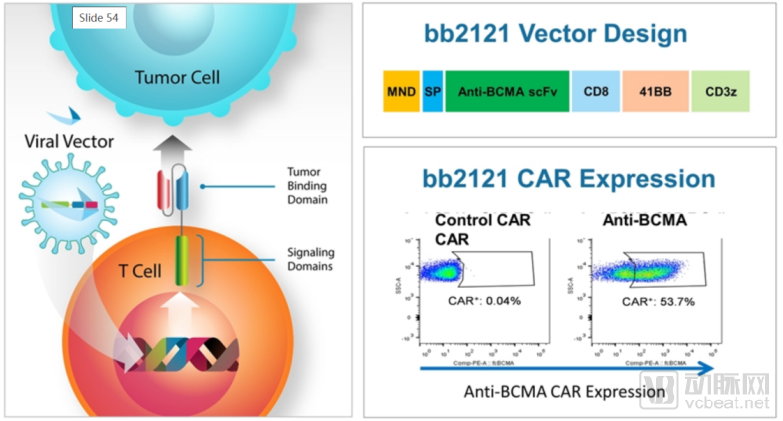
BMS和bluebird bio联合宣布,已递交CAR-T疗法bb2121的BLA,用于治疗复发/难治性多发性骨髓瘤(R/R MM)患者,这是首款递交上市申请的靶向BCMA的CAR-T疗法。
B细胞成熟抗原(BCMA)是一种在多发性骨髓瘤的癌细胞上普遍表达的蛋白质,它是这种侵袭性血液癌症的重要潜在靶点。ide-cel可以识别并与多发性骨髓瘤细胞表面的BCMA结合
在名为KarMMa的关键性单臂、开放标签2期临床试验中,R/R MM患者都已经至少接受过免疫调节药物(IMiD)、蛋白酶体抑制剂(PI)、和抗CD38抗体的治疗,并且对疗法产生耐药性。其中94%的患者对抗CD38抗体疗法产生耐药性,84%的患者具有三重耐药性。
在总计128名能够评估疗效的患者中,患者的客观缓解率(ORR)达到73.4%,完全缓解率(CR)达到31.3%。在中位随访时间为11.3个月时,这些患者的无进展生存期(PFS)达到8.6个月。
第一三共和阿斯利康公司宣布,ADC-DS8201在治疗先前接受过治疗的HER2过度表达癌症患者的1期临床试验中,将55.6%的非小细胞肺癌(NSCLC)患者的肿瘤缩小
Enhertu利用了第一三共特有的ADC技术,将人源HER2抗体曲妥珠单抗通过四肽接头与一种新型拓扑异构酶1抑制剂链接,靶向癌细胞,并将药物递送至细胞内部
共有60名经治HER2过度表达或突变的癌症患者参与该项1期临床研究,其中包括18名NSCLC患者、20名CRC患者,和其他几名不同肿瘤类型的患者。
NSCLC患者的客观缓解率最高,其中55.6%的患者肿瘤被缩小,中位缓解时间达到10.7个月。在携带HER2突变的NSCLC患者中的疗效更为明显,Enhertu的治疗使该组中72.7%的患者得到缓解
BB2121的原理
数据来源:bluebird
美国FDA批准由法国公司LFB Biotechnology开发的Sevenfact上市,用于治疗和控制成人及12岁以上青少年A型或B型血友病患者的出血事件
Sevenfact的活性成分是人类凝血因子VII的重组类似物,在基因工程改造的兔子的乳腺中表达,并分泌到兔的乳汁中。乳汁纯化和加工过程中,因子VII转化为活化的因子VIIa
该研究评估了27位携带凝血因子抑制因子的A型或B型血友病患者。
试验结果表明,对于轻度或中度出血事件,采用较低剂量(75 μg/kg)和较高剂量(225 μg/kg)Sevenfact治疗成功的比例约为86%
百时美施贵宝(BMS)和Acceleron Pharma宣布,FDA批准双方共同开发的红细胞成熟剂Reblozyl(luspatercept-aamt),用于治疗极低至中等风险骨髓增生异常综合征患者中出现的贫血
Reblozyl能够作为TGF-β的配体陷阱(ligand trap),防止TGF-β激活Smad2/3信号通路,进而促进晚期红细胞的分化和成熟
MEDALIST是一项随机双盲、安慰剂对照、多中心3期临床研究
在试验中,与接受安慰剂治疗的患者相比,在试验的前24周内,接受Reblozyl治疗的患者中实现了至少8周RBC输注独立的比例显著增加,达到了研究的主要终点。
葛兰素史克(GSK)宣布,其抗IL-5单克隆抗体Nucala(mepolizumab),在治疗伴有鼻息肉的慢性鼻窦炎(CRSwNP)患者的关键性3期临床试验SYNAPSE中,达到了试验的主要终点和关键性次要终点
Nucala通过抑制IL-5信号通路,它有望减少嗜酸性粒细胞的生长,缓解多种因为嗜酸性粒细胞过多导致的疾病。
为期52周,随机,双盲的3期临床研究。
与只接受标准疗法治疗的对照组相比,Nucala与标准疗法的联合治疗,使患者的鼻息肉大小在第49周和第52周都达到了统计学意义上的显著改善。此外,该研究还减少了57%患者在52周治疗期内的首次手术需求,即该试验的关键性次要终点
Mesoblast公司宣布,美国FDA已接受其同种异体细胞疗法Ryoncil(remestemcel-L)的生物制品许可申请(BLA),用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿童患者
Ryoncil通过抑制T细胞增殖,和下调促炎细胞因子和干扰素的产生,来调节T细胞介导的炎症反应
3期临床试验结果显示,与既往实验对比。
患者接受Ryoncil治疗后第28天的ORR为69%,与45%历史控制率相比,有统计学意义的显著增加。在接受至少一次输注治疗且随访100天的患者中,患者的死亡率为22%。而接受初始类固醇治疗无效的患者第100天死亡率高达70%
❖吉利德科学(Gilead Sciences)旗下Kite公司和Teneobio公司联合宣布,双方已达成一项许可和合作协议。他们将利用Teneobio专有的人源重链抗体(UniAb)平台开发新一代具有双重靶向的CAR-T疗法,治疗多发性骨髓瘤(MM)患者。
❖癌症免疫疗法公司Fate Therapeutics宣布与杨森(Janssen)公司达成一项全球合作协议,以利用其诱导多能干细胞(iPSC)平台和杨森专有的抗原结合结构域,开发新型CAR-NK和CAR-T疗法。Fate公司将获得5000万美元的预付款和5000万美元的股权投资,以及研究和开发候选药物所需的资金。此外,Fate还将有资格获得高达30亿美元的潜在里程碑付款。
❖默沙东宣布Keytruda单药一线治疗伴有微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)的不可切除或转移性结直肠癌患者的III期KEYNOTE-177研究到达了复合主要终点中的一个,相比对照组显著改善了患者的无进展生存期(PFS)。
❖灵北制药在官网上公布了两项IIa期临床研究的失败结果。一个是代谢型谷氨酸受体4(mGluR4)调节剂foliglurax,拟开发用于治疗帕金森病患者运动症状;另一个是选择性丝氨酸水解酶单酰甘油脂肪酶(MGLL)抑制剂Lu Ag06466(ABX-1431),拟开发用于治疗Tourette综合征。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。