
# 热门搜索 #
昂瑞生物:自研肿瘤疫苗联合一线化疗SOC实现肿瘤特异的免疫应答,有望成为卵巢癌一线治疗
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持著名的免疫学家Laurie H. Glimcher博士曾这样形容传统免疫疗法难以攻克冷肿瘤的原因:“冷肿瘤就像是一座被护城河环绕的城堡,被护城河阻拦的T细胞难以攻击城堡,而城堡内的T细胞又很少,因此检查点抑制剂的疗效可能不及对抗热肿瘤的疗效。”
冷肿瘤主要是指一些缺乏原始免疫应答的肿瘤,其肿瘤内部的T细胞含量很少;而与之相对的则是热肿瘤,热肿瘤内部已经包含大量的浸润T细胞,它们是目前免疫检查点抑制剂疗法和组合疗法治疗的热门肿瘤类别。
然而,目前为止仅有八种肿瘤(膀胱癌、头颈癌、肾癌、肝癌、黑色素瘤、非小细胞肺癌以及具有MSI遗传特性的肿瘤)是“热”的,也就意味着除这八种肿瘤之外的其他癌种的肿瘤患者无法受益于传统免疫疗法。而在冷肿瘤领域,胃肠系统肿瘤、胶质母细胞瘤、卵巢癌、前列腺癌和胰腺癌等等,因为其缺乏最基本的免疫反应,免疫检查点抑制剂疗法(例如PD-1/PD-L1)对这类患者的治疗效果非常低,甚至于还会干扰T细胞功能,产生副作用。

昂瑞生物的共同创始人兼CEO 史跃年博士
生物制药公司昂瑞生物的共同创始人兼CEO史跃年博士直言道:“第一代肿瘤免疫疗法PD-1/PD-L1的痛点就揭示了下一代肿瘤免疫疗法的热点——如何提高肿瘤病人的原始免疫应答?”
生动的理解就是怎么将冷肿瘤变“热”?这是目前肿瘤治疗领域的热门话题。史博士向记者介绍了几种常见的提高人体免疫反应的方法:
其一,从冷肿瘤中直接提取少量的自体T细胞,然后进行体外大量培养,然后再将大量培养的T细胞输送回患者体内,实现提高免疫反应的效果。该方案理论上是最合适治疗冷肿瘤的,但因其实际操作步骤繁琐,该方案的商业化程度低;
其二,为冷肿瘤寻找新抗原(Neoantigen)。肿瘤在恶化过程中抗原出现了免疫耐受性,如果抗原发生突变,就可能变成新抗原,新抗原则会重新激活免疫反应。但肿瘤抗原突变是随机、无法掌控的,且突变后不一定能产生新抗原。
昂瑞生物瞄准了第二种将冷肿瘤变“热”的方法,尝试为卵巢癌患者寻找新的免疫点,即新抗原。与传统通过基因突变产生的Neoantigen不同,昂瑞生物通过非人源化的“表达”,人为干预原已经免疫耐受的肿瘤抗原。史博士进一步解释道:“在一线化疗药物的配合下,我们让全鼠源化的抗体与肿瘤抗原结合,形成抗原-抗体复合物,让原有的抗原具有外来性,发生改变,形成新抗原,从而引起免疫反应,重新激活免疫系统。”
传统意义上的新抗原是突变产生的,昂瑞生物重新定义了“Neoantigen”,该公司的“Neoantigen”属于更加广义的新抗原,实为一种具有鼠源属性的抗原抗体复合物。这与传统的以靶点成药的肿瘤疗法大相径庭,之所以产生这样的治疗思路,史博士说道:“这个有一定的历史原因,十几年做的三期临床,那是还没有人知道如何设计IO这个领域的临床方案,重新拾起了当初失败的临床项目,开始琢磨失败的原因,通过IIA的临床方案设计,就走上了这条研发肿瘤疫苗的道路。”
Oregovomab是昂瑞生物的主要产品,由OncoQuest INC.授权,在大中华区拥有独家商业权。基于“Neoantigen”这种原理,昂瑞生物已经开启了多条肿瘤疫苗的研发管线(如下图所示)。
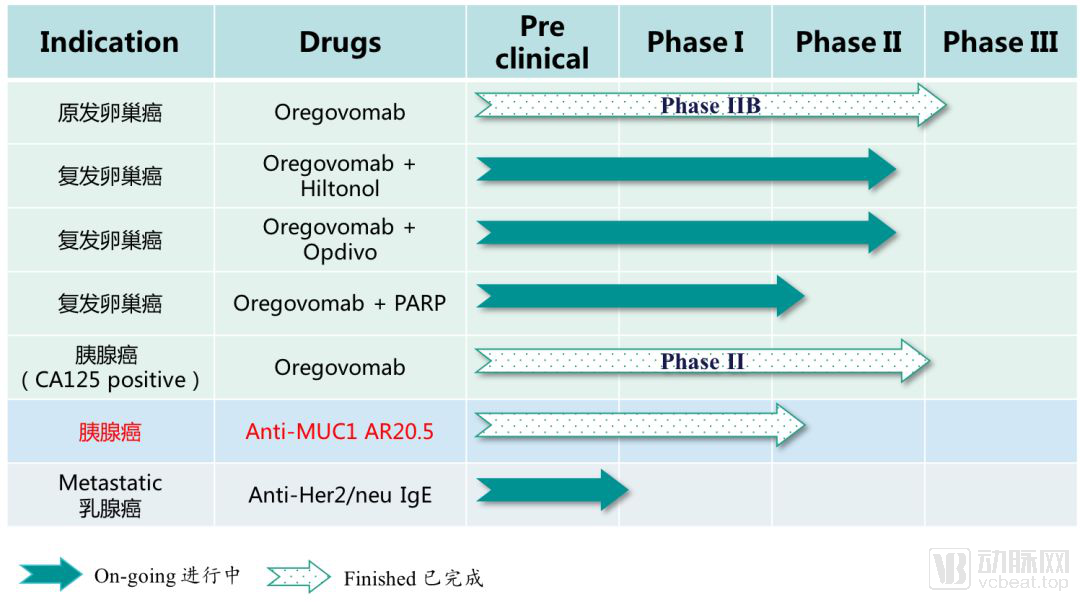
昂瑞生物的研发管线
其中,昂瑞生物进展最快的是用以治疗原发性卵巢癌的Oregovomab管线。Oregovomab是一种高亲和力的单克隆抗体(Mab B43.13),能够与卵巢癌抗原CA-125相结合,启动针对该抗体的系列免疫反应。
CA-125是在卵巢癌患者癌细胞膜上特有的一种糖蛋白,多被用于卵巢癌的预后指标检测。CA-125原本在卵巢癌患者体内不会引发免疫反应,但昂瑞生物“重新定义”CA-125,将其视为一个新的“免疫点”,赋予CA-125“新特征”,促使其引发免疫反应。
这种赋予CA-125的新特征的方法就是通过肿瘤疫苗Oregovomab实现。昂瑞生物将鼠源抗体Xenotypic IgG1与肿瘤抗原CA125结合,形成抗原-抗体复合物。该复合物即Neoantigen,具有更佳的免疫原性,从而激活免疫系统。Oregovomab的另一个创新之处在于,由于Oregovomab是鼠源抗体,注入人体后,会产生“人抗鼠”(HAMA Response)免疫反应,能够迅速激活人体免疫系统。鼠源抗体这种“外来性”起到一种类似免疫佐剂的作用。
昂瑞生物和OncoQuest INC.在临床实践中发现,Oregovomab需要与一线化疗方案(SOC)联用方能明显改善卵巢癌的治疗效果。史博士解释道:“临床前和临床数据已经表明,化疗会适度改变肿瘤微环境,同时也有可能改变肿瘤表面抗原。而以卡铂/紫杉醇为代表的SOC能够杀死部分肿瘤细胞,致使CA-125脱落,促进Oregovomab与之形成Neoantigen。”
目前,昂瑞生物和OncoQuest INC.已经完成了Oregovomab的IIb期临床试验,共有97例新确诊的存在转移的卵巢癌晚期病人入组,设计了47人的IIb临床设计试验组(SOC+Oregovomab)和50人的对照组(SOC)。试验组分别在化疗的第1、3、5个疗程与化疗同时给Oregobomab抗体药,每次给药2mg/患者,最后一个疗程结束后再给药一次,总共8mg/病人,然后观察36个月,在此期间不再给药。

Oregovomab的IIb期临床设计
IIb期临床结果显示,Oregovomab配合SOC的临床治疗效果显著,试验组患者的无进展生存期(PFS)为41.8个月,对照组患者的无进展生存期(PFS)则只有12.2个月,试验组PFS值约为对照组的3.5倍。
目前,昂瑞生物和OncoQuest INC.正在启动针对原发卵巢癌一线治疗的III期临床研究,计划招募500多名全球新诊断的晚期卵巢癌患者,进一步评估接受Oregovomab联合SOC的患者与单独SOC治疗的患者的PFS对比。
与一线化疗药联合用药,让Oregovomab有可能成为治疗卵巢癌的一线药物。对比市面上已获批的肿瘤药物Olaparib,需要患者对SOC有完全或部分反应后才能进行Olaparib治疗,Oregovomab则没有这方面限制,可以直接与SOC联用,且无已知的副作用。而Olaparib治疗不能与SOC联用,并伴有中性粒细胞减少等副作用。
此外,Oregovomab和传统的针对靶点的治疗型药物不同,Oregovomab是用以促使机体形成新抗原,而非阻断靶点。所以在药物计量上仅每次注射2mg即可达到治疗效果,而以PD-1靶点成药的Opdivo药物为例,该药每次注射用量在500 mg,是Oregovomab用量的百多倍。
除了核心管线Oregovomab,另一款处于临床阶段的肿瘤药物是BrevaRex单抗。该药能够用于治疗表达MUC1肿瘤抗原的恶性肿瘤,并且已经完成了FDA I期临床实验。在FDA I期临床实验中,BrevaRex单抗表现出了良好的耐受性,可以激活针对MUC1的T细胞。计划在明年启动BrevaRex的II期临床。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。