
# 热门搜索 #
糖尿病患者注射胰岛素越打越胖!未来,这类药物将替代胰岛素
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持2019年3月,以 “药物发现与技术创新” 为主题的Queenstown Molecular Biology Meetings在上海举行。国家新药筛选中心主任王明伟研究员和新西兰奥克兰大学Peter Shepherd教授共同主持了学术盛典。加拿大多伦多大学Daniel Drucker教授做了主题为 “GLP-1受体激动剂治疗糖尿病和代谢病”的专场报告,引起巨大反响。

Daniel Drucker, MD,PhD
Drucker教授是GLP-1领域的奠基人和杰出领袖。他在GLP-1药物研究和治疗领域取得了开创性成就,这使得他成为第74届美国糖尿病协会科学年会(ADA,2014)班廷奖章(Banting Award)获得者。
早在1987年,Drucker教授就观察到GLP-1能促进了胰岛素释放,推测其“是胰岛素基因表达的生理调节者”,由此开始了他专注于GLP-1的研究生涯。三十余年来,他获得了29项美国专利,其科研成果引发了糖尿病治疗史上的革命,直接孕育和孵化了GLP-1受体激动剂及二肽基肽酶(DPP-4)两大类药物,这些丰富和直接的转化医学成果让全球不计其数的患者从中获益。
作为内分泌医生,加拿大班廷-百斯特糖尿病研究中心(BBDC)前主任,Drucker教授在报告中叙述了GLP-1的发现,并介绍了生物学功能和药学机理。他从第一个上市的短效药物(艾塞那肽)开始,并对到目前的长效GLP-1药物(度拉鲁肽)做了系统回顾,展望了GLP-1药物开发的前景。
1921年,多伦多大学生理系的班廷教授(Frederick Banting)和他的学生百斯特(Charles Best)发现了胰岛素及其治疗糖尿病的功效。这是医学界的一个巨大革命,1923年班廷因此获得诺贝尔奖。
在随后的近100年里,胰岛素一直是治疗糖尿病的一线注射药物。然而,GLP-1的出现打破了胰岛素100年来的一线用药地位的局面。GLP-1受体激动剂不仅具有与胰岛素类似降糖功效,其益处来自其多效性作用,包括食欲控制、减肥和心血管获益作用(1)。这些益处,是胰岛素和其他口服降糖药所不具备的。
胰岛素治疗有发生低血糖的高风险,而GLP-1是以血糖依赖的形式降糖的,因此发生低血糖的风险极低。大多数2型糖尿病患者是肥胖患者,在胰岛素注射治疗中伴随的体重进一步增加,会加剧患者机体代谢紊乱以及糖尿病相关并发症(包括微血管和大血管并发症),而导致的死亡风险(2)。GLP-1药物治疗具有的减肥功效对糖尿病患者非常有益。更为重要的是,其心血管获益作用为长期GLP-1治疗提供了卓越的临床依从性。

Discovery of insulin by Drs. Banting and Best in 1921
Drucker教授还从市场角度分析了药物的开发前景。GLP-1药物目前占了整个糖尿病治疗药物的10%的销售,而中国只占了2-3%,有巨大的提升空间。Drucker教授在期报告结语中乐观地指出:在不久的将来,GLP-1类药物将取代胰岛素成为糖尿病治疗的主线药物。
GLP-1作为一线用药进入美国糖尿病指南
2019年,美国糖尿病协会(American Diabetes Association – ADA) (3) 和欧洲糖尿病协会(European Association for the Study of Diabetes,EASD) (4)推出了新的医治标准指南。指南建议不将胰岛素作为2型糖尿病的一线治疗,并将GLP-1受体激动剂在大多数情况下作为糖尿病的首选注射疗法。其依据概括为如下三方面:
1) GLP-1具有与胰岛素类似降糖功效,但低血糖风险非常低;
2) GLP-1不仅没有胰岛素治疗伴随的增加体重的副作用,还有减肥功效;
3) GLP-1具有心血管保护功能(表1)。

表1. 胰岛素与GLP-1类药物降糖特点的比较
在确诊为动脉粥样硬化性心血管疾病的2型糖尿病患者中,使用GLP-1受体激动剂可具有“已证实的心血管疾病益处”。指南还建议,2型糖尿病合并慢性肾病患者可用GLP-1受体激动剂。针对妊娠期糖尿病高血糖症患者,不建议二甲双胍和格列本脲作为一线药物,因为它们会穿过胎盘影响胎儿,需要考虑GLP-1受体激动剂等其他药物。
近年来胰岛素销售逐年下降, GLP-1药物市场直线上升(见图1)。随着2019年新指南的推出,这一趋势将更加明显。
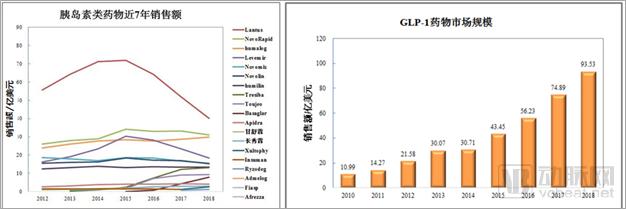
图1. 胰岛素全球销售逐年下降,GLP-1药物持续上升
来源:Armstrong,2018年糖尿病市场研究报告:GLP-1受体激动剂一枝独秀
唯有人源性长效GLP-1能使心血管获益
糖尿病权威专家John B. Buse教授2019年6月在《代谢》杂志(5)发表了一篇论文,对ADA-EASD指南认定GLP-1作为糖尿病治疗一线用药做了深度的分析和评价。Buse教授是ADA颁发的2019年临床糖尿病研究杰出成就奖的获得者。该奖项表彰在以患者为导向的临床研究中做出的卓越贡献,对糖尿病防治具有重大影响的临床科学家。

John B. Buse, MD,PhD (图片来自网络)
Buse教授指出,2型糖尿病是一种渐进性慢性疾病,治疗过程中需要考虑患者因素,包括患者的自我护理、合并症的发生和长期承担药物治疗费用的压力。
文章回顾,在2005年美国FDA批准GLP-1受体激动剂(艾塞那肽)上市之前,胰岛素是糖尿病的唯一注射药物。此后,FDA又批准了5种GLP-1受体激动剂:利西塞那肽、阿必鲁肽、杜拉鲁肽、利拉鲁肽和索玛鲁肽。
GLP-1药物分为动物源性(艾塞那肽和利西塞那肽)和人源性(利拉鲁肽,索玛鲁肽,杜拉鲁肽和阿必鲁肽)两类。动物源性(艾塞那肽、利西塞那肽)是短效的,尽管艾塞那肽运用微球缓释技术做成了长效周制剂。人源是长效的,利拉鲁肽每日一次,阿必鲁肽、杜拉鲁肽和索玛鲁肽是每周注射一次。
对医生和患者来说,权衡每种选择的风险和益处,以及指导选择一种药物时的考虑因素非常重要。糖尿病治疗的最大危害是低血糖的发生,GLP-1受体激动剂的药物作用是血糖依赖性的,因此几乎不发生低血糖事件。GLP-1受体激动剂治疗的另一个主要优点是它能够促进饱腹感,帮助患者再临床意义上减轻体重。而胰岛素治疗通常易导致体重增加。考虑到肥胖对血糖控制的负面影响,两者间的这一点差异非常重要的。
当药物导致体重增加进一步需要强化糖尿病治疗时,会产生恶性循环。胰岛素引起的体重增加不仅发生在初始治疗,随着时间的推移,随着胰岛素剂量的增加而累积发生。GLP-1 受体激动剂的减肥作用对肥胖性糖尿病的治疗的意义重大。
心血管疾病是2型糖尿病患者最常见的并发症和疾病致死的主要原因。因此,通过控制高血糖和改善代谢综合征,以善终心血管疾病患者结局的药物的开发是当务之急。2型糖尿病患者需要终身用药,因此具有心血管保护作用的GLP-1药物将有卓越的依从性(6)。GLP-1药物的这些特征为ADA-EASD制定的“GLP-1类药物替代胰岛素,作为2型糖尿病人大多数情况下的第一种注射疗法”的指南提供了理论依据。
Buse教授还指出, GLP-1的停药率通常高于基础胰岛素。为了尽量减少胃肠道症状的风险,患者应服用最低剂量的GLP-1,并缓慢向上滴定。因此,高效低剂量的GLP-1药物将受患者的欢迎。
此外,应该考虑到2型糖尿病需要终身用药,药物的价格直接影响患者的生活质量。如果能够降低GLP-1药物制作成本和销售价格,将为GLP-1药物作为糖尿病治疗主线用药的正推广铺平道路。
人源性长效GLP-1受体激动剂将成主角
至今,获美国FDA和欧洲EMEA批准上市的(包括人源和动物源)共有6个品种(表2)。
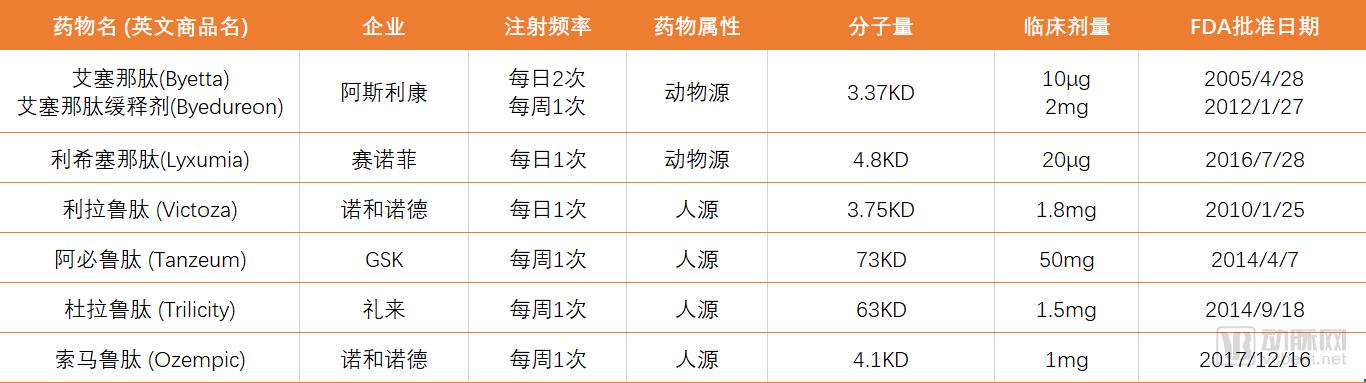
表2. FDA和EMEA批准上市的GLP-1药物共有6个品种
其中,艾塞那肽(2010-10-21)和艾塞那肽缓释制剂(2018-05-18,三生制药获得中国销售代理权)、利拉鲁肽(2011-04-13)和度拉鲁肽(2019-02-26)已在中国上市。
引人注目的是,具有自主知识产权的国产创新药贝那鲁肽(仁会生物,人源短效,每天注射3次, 2016年12月19日)和聚乙二醇洛赛那肽(豪森制药,动物源长效,每周注射1次,2019年5月6日)也相继上市。截止今日,在中国CDE登记注册处在临床研究阶段GLP-1受体激动剂药物约20个。GLP-1药物的开发已经成为糖尿病领域的热点。
咋一看,GLP-1药物众多,貌似非常拥挤的领域。但稍作梳理可发现,GLP-1药物主要可从两个维度来区分:人源性或动物源性的;短效或长效的。人源长效GLP-1药物,不仅展示了卓越的临床表现,还能显著降低2型糖尿病患者因心血管疾病导致的死亡风险。动物源性(蜥蜴)的氨基酸序列只有人源GLP-1约50%,除了注射部位的局部反应外还有机体的免疫反应,众多的临床研究包括一项发表在新英格兰医学杂志的大型国际多中心的2型糖尿病研究表明,动物源性GLP-1受体激动剂(如艾塞那肽)没有心血管获益作用(2)。先前2型糖尿病药物相关研究引发了人们对于降糖药物心血管风险的担忧,为此,FDA出台了糖尿病药物必须开展心血管风险评估研究的规定。
显然,糖尿病药物不具有心血管获益功效将不被医生和患者采纳。
2018年GLP-1药物市场数据显示,人源长效GLP-1利拉鲁肽和度拉鲁肽独占鳌头,占了整个GLP-1药物市场的85%的份额(表3)。长效和短效制剂是相对而言的,每天一次的利拉鲁肽相对每天两次的艾塞那肽是长效,但相对于其后上市的周制剂则是短效了。周制剂的度拉鲁肽已对每日一次的利拉鲁肽形成了超越之势。
诚然,临床研究的数据总是引导着药物市场的走向。虽然具有长效周制剂的特征,但由于是动物源,艾塞那肽微球释放(2012年)即使比杜拉鲁肽(2014)早先上市,其销售一直低迷持续下滑。
最新的临床研究数据显示,杜拉鲁肽和索玛鲁肽具有令人满意的的心血管获益功效(7,8)。基于这些数据,业界专家预测,在今后的3-5年里,长效制剂度拉鲁肽(2018年销售31.99亿美金)和索玛鲁肽(2018年销售2.97亿美金)将各自达到50-100亿销售的市场。因此,人源性长效GLP-1受体激动剂将引领糖尿病药物市场。
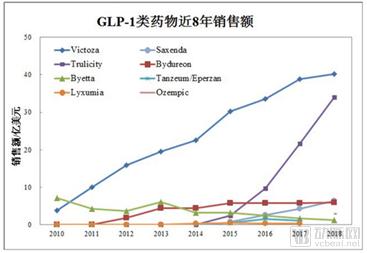
表3 . 最近8年GLP-1受体激动剂药物的销售
来源:Armstrong,2018年糖尿病市场研究报告:GLP-1受体激动剂一枝独秀
人源长效GLP-1药物的结构特征分析
CED公开资料显示,在中国上市或处于临床阶段的人源长效GLP-1药物共有4个:礼来的度拉鲁肽、诺和诺德的索玛鲁肽、银诺医药的苏帕鲁肽和鸿运华宁的GMA102 (表3)。度拉鲁肽注射液已经完成在中国的临床研究,并在2019年2月26日经CDE批准在中国上市。
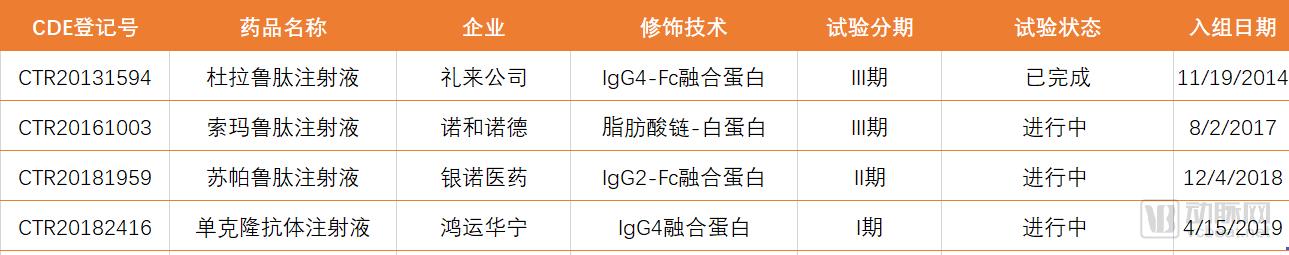
表3. 在中国上市的或在临床阶段的人源长效GLP-1药物,数据来自CED公开资料。
概括地讲,这些人源长效GLP-1药物的共同特征是运用基因工程技术使GLP-1类似物与人体的免疫球蛋白IgG(FC片段)或者人体白蛋白(albumin)融合或结合,使其在体内避免快速被肾脏清除和代谢降解,延长半衰期。
杜拉鲁肽为GLP-1与人IgG4-Fc连接的融合蛋白,由将GLP-1类似物的N-末端与经过修饰的人IgG4重链Fc段,通过一个人工链接物(artificial linker)共价连接形成。该蛋白与天然人GLP-1有90%同源性,分子量63kDa。
苏帕鲁肽为GLP-1与人IgG2-Fc连接的融合蛋白,是将GLP-1类似物的N-末端与人IgG2重链Fc段,通过免疫球蛋白的天然铰链区(hinge)共价连接形成。该蛋白与天然人GLP-1有97%同源性,分子量60kDa。
GMA102(单克隆抗体注射液)为GLP-1与人IgG4连接的融合蛋白,是由基因工程手段将GLP-1类似物的N-末端,与整个人IgG4分子通过一个人工链接物(artificial linker)共价连接行程。该蛋白与天然人GLP-1有97%同源性,分子量157kDa。
索马鲁肽为GLP-1经修饰连接18碳脂肪二酸侧链其与人白蛋白结合形成大分子结合物。该分子是用基因工程手段将GLP-1类似物的序列位置26处的赖氨酸以其衍生物形式存在(用硬脂二酸酰化),通过一个间隔物和C-18脂肪二酸侧链进行酰化后与人白蛋白结合形成大分子结合物。该蛋白与天然人GLP-1有94%同源性,分子量70.6kDa。
这些人源长效GLP-1药物的共同特征是运用基因工程技术使GLP-1类似物与人体的免疫球蛋白IgG(FC片段)或者人体白蛋白(albumin)融合或结合,使其在体内避免快速被肾脏清除和代谢降解,延长半衰期。
运用IgG-Fc结构域与效应分子(如GLP-1)融合以赋予药物体内稳定性,这类称为Fc融合蛋白的药物通常不含IgG轻链只含两条重链的Fc部分,旨在增强热应激稳定性(9)。杜拉鲁肽和苏帕鲁肽都遵循了这个设计原理。
GMA102是GLP-1类似物与整个人IgG4分子通过一个人工链接物(artificial linker)共价连接而成的融合蛋白。保留IgG轻链的理由可以理解为Fab将融合蛋白带到靶向细胞,使融合蛋白的GLP-1结合GLP-1受体并激活受体后信号通路。事实上,GLP-1本身具有很强的GLP-1受体亲和力,不需要任何辅助手段。保留轻链的IgG融合蛋白不仅会减弱融合蛋白的热稳定性,且由于分子量大,通常需要使用更高浓度的药物来达到预期的功效。
人类的IgG有四个亚型。Fc可以结合血循环中的可溶性Fcγ受体,激活免疫细胞的效应器功能,旨在破坏病原体或杀伤细胞(如肿瘤细胞)(10)。IgG1和IgG3与所有FcγRs有较高的亲和力,因此人们通常选用IgG1或IgG3用作抗炎症或抗肿瘤药。相比较,IgG4能以较低的亲和力结合Fcγ受体。在所有的IgG亚类中,IgG2对FcγRs的亲和力最低,因此IgG2具有更好的安全性(11)。
GLP-1经修饰通过脂肪二酸侧链与人白蛋白结合形成大分子结合物的索马鲁肽是一个智慧的设计。诺和诺德公司使用美国Emisphere 制剂公司的独特技术(http://www.emisphere.com/)正在开发口服制剂索玛鲁肽。该药物是每日服用1次的GLP-1药物,目前正在进行三期临床试验。
注射制剂 vs口服制剂:依从性及潜在风险
美国糖尿病学会近年都有一个糖尿病注射用药的专场讨论(injectable drug)。显而易见,通过注射途径递送的药物具有清晰的药代动力学反应特征,生物利用度高,drug-drug相互作用的负面风险最小化。
虽然注射技术已经达到无针、无痛注射,但人们与生俱来就有对注射的恐惧感。这是患者渴望口服制剂的主要原因。早在胰岛素发明的第二年,也就是1922年,Elliott P. Joslin博士就曾尝试应用口服胰岛素制剂治疗糖尿病。在这之后的近100年里,尝试口服胰岛素的努力均以不成功而告终。
药代动力学反应的缺失是口服胰岛素开发面临的一个主要挑战。事实上,2型糖尿病患者自身有分泌胰岛素的能力,但是缺乏对餐后血糖上升的即刻响应,即专业术语胰岛素分泌第一时相的缺失。即使当今人们能够克服“肠道壁垒”的难题,确保蛋白药不被降解、完整地透过肠壁进入血循环患者需要至少服用药物20分钟后才能达到有效血药浓度(12)。这意味着,机体对胰岛素在餐后的即刻需求是口服制剂无法达到的。另外,食物(或者其他药物)与口服胰岛素之间相互作用也使得口服胰岛素的治疗面临潜在风险。
虽然在 “精心”设计的临床研究中,研究者可以让受试患者保持空腹并且不服用任何其他药物。但是在现实世界, 2型糖尿病患者多数是老年人,多伴随其他代谢性疾病,包括高血压,高血脂,冠心病。这些患者常常是“一大把药物同时服用”。药物-药物相互作用(drug-drug interaction),以及摄食对药物的潜在危害是不可忽略的风险。
有学者指出(10),目前口服胰岛素研究的文献进展令人失望,所有提出的试验都是早期的可行性和概念验证试验,试验对象数量很少。尽管这些概念验证试验的结论毫无例外地表明口服胰岛素是可行的,但仔细观察设计和数据,可以发现这些试验其实有改进的空间(13)。2017年诺和诺德宣布终止口服胰岛素3期临床研究,这说明真正距离实现临床使用口服胰岛素还有漫长的路要走。
与胰岛素相比,GLP-1具有独特的生物学功能,其降糖功效可根据患者血糖水平变化而变化。因此,与胰岛素相比较,即使通过口服,GLP-1的药代动力学反应的缺失不再是一个主要挑战。但是,由于2型糖尿病患者常常需要同时服用多种药物,口服GLP-1类药物类药物面临的主要挑战是摄食及药物-药物相互作用的潜在危害。口服多肽或重组蛋白药物的最终成功,需要大量的临床研究以及上市后真实世界患者的验证。另外,由于口服制剂的生物利用度非常低,通常需要注射制剂的10-100倍以上的药量。其制作成本和价格也是決定该药物能否获得美国保险业者和歐洲医疗保健系统采用的关键(13)。
小结:
随着GLP-1药物作为2型糖尿病一线药物进入ADA-EASD指南,GLP-1药物将有着极大的市场需求。长效人源GLP-1类药物具有胰岛素类似的降糖功效,不仅低血糖风险极低,其减肥及心血管获益功能还使得长期GLP-1治疗的患者获得更大程度的收益。
2型糖尿病患者需要终身药物治疗。医生需要考虑患者的自身因素,这些因素对疾病的治疗有重要影响。这些因素包括患者的自我护理、合并症的发生和长期承担药物治疗费用的压力。
总体而言,市场需要高质量、低成本、患者负担得起的、具有多效性作用以改善患者代谢综合征及生活质量的糖尿病药物,长效的人源GLP-1类药物将是今后主导糖尿病市场的主力军。
参考文献:
1. J. Li, J. Zheng, S. Wang et al., Cardiovascular Benefits of Native GLP-1 and its Metabolites: An Indicator for GLP-1-Therapy Strategies. Front Physiol 8, 15 (2017).
2. R. R. Holman, M. A. Bethel, R. J. Mentz et al., Effects of Once-Weekly Exenatide on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 377, 1228-1239 (2017).
3. https://professional.diabetes.org.
4. https://www.easd.org.
5. A. S. Alexopoulos, J. B. Buse, Initial injectable therapy in type 2 diabetes: key considerations when choosing between glucagon-like peptide 1 receptor agonists and insulin. Metabolism, (2019).
6. A. C. Sposito, O Berwanger, LSF de Carvalho et al., GLP-1RAs in type 2 diabetes: mechanisms that underlie cardiovascular effects and overview of cardiovascular outcome data. Cardiovasc Diabetol. 17(1), 157 (2018).
7. H. C. Gerstein, H. M. Colhoun, G. R. Dagenais et al., Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 394, 121-130 (2019).
8. H. C. Gerstein, H. M. Colhoun, G. R. Dagenais et al., Dulaglutide and renal outcomes in type 2 diabetes: an exploratory analysis of the REWIND randomised, placebo-controlled trial. Lancet 394, 131-138 (2019).
9. Y. Wang, Q. Lu, SK Wu et al., Characterization and comparison of disulfide linkages and scrambling patterns in therapeutic monoclonal antibodies: using LC-MS with electron transfer dissociation. Anal Chem. 2011 Apr 15;83(8):3133-40.
10. C. Rosales, Fcgamma Receptor Heterogeneity in Leukocyte Functional Responses. Front Immunol 8, 280 (2017).
11. P. M. Hogarth, G. A. Pietersz, Fc receptor-targeted therapies for the treatment of inflammation, cancer and beyond. Nat Rev Drug Discov 11, 311-331 (2012).
12. E. Zijlstra, L. Heinemann, L. Plum-Morschel, Oral insulin reloaded: a structured approach. J Diabetes Sci Technol 8, 458-465 (2014).
13. A. W. Michels, P. A. Gottlieb, Learning From Past Failures of Oral Insulin Trials. Diabetes 67, 1211-1215 (2018).
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。