
# 热门搜索 #
君联医疗全球新药资讯速递 · 第30期
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持
本周新药数据共10个,其中肿瘤4个,抗感染2个,血液1个,肾病1个,肝病1个,代谢1个
❖ 陈列平团队创办的Nextcure近日更新了Siglec15(S15)单抗NC318的一期临床数据,在NSCLC中表现亮眼,ORR为29%(2/7),DCR为71%(5/7),股票也大涨248.92%。自PD1/PDL1后,全世界都在找下一站天后,但自从IDO折戟后,无数潜在的靶点即使与PD1 combo也看不到promising的数据,IO领域开始处于阶段性的低潮。现在Siglec15横空出世,而且有可能是不依赖PD1起作用,值得期待。后续预计国内也会出现很多fast follow的机会
❖ 美国Halozyme宣布透明质酸酶制剂PEGPH20的胰腺癌三期临床失败。此前PEGPH20作为一种潜在可以加快皮下注射吸收的技术,受到很多重磅抗体药物企业的青睐,去年公司与施贵宝、罗氏的20亿美元合作也很吸引眼球。不过,继住友的napabucasin(Stat3抑制剂,3期)和礼来的pegilodecakin(Peg-IL10,3期)失败后,PEGPH20也不幸中枪。胰腺癌被称为万癌之王,5年生存率仅为8%,晚期胰腺癌的中位生存期仅为3个月,现在新MoA的药物频频失利,而且都是在3期才失败,沉没成本非常高。未来针对胰腺癌的pipeline,可能需要打一个比较高的风险系数
NextCure二代免疫药物NC318公布1/2期临床数据
NextCure公司公布了其新型免疫药物NC318的最新数据
NC318是一款单克隆抗体,作用靶点是siglec-15(S15),其在肿瘤细胞和M2巨噬细胞表面表达,能够强有力地抑制T细胞的激活,从而抑制人体对癌症细胞的免疫反应
6个剂量递增队列(8-800mg,2周一次)共纳入了43例经治晚期实体瘤患者,常见癌种包括10例非小细胞肺癌(NSCLC)、7例卵巢癌、6例黑色素瘤、3例乳腺癌和3例结直肠癌
共有32例患者可评估疗效,在NSCLC中,1例患者达到完全缓解、持续41周;另外1例部分缓解、持续14周;还有3例患者达到疾病稳定;ORR为29%(2/7),DCR)为71%(5/7)
NC318通过siglec-15抑制免疫过度表达的机制
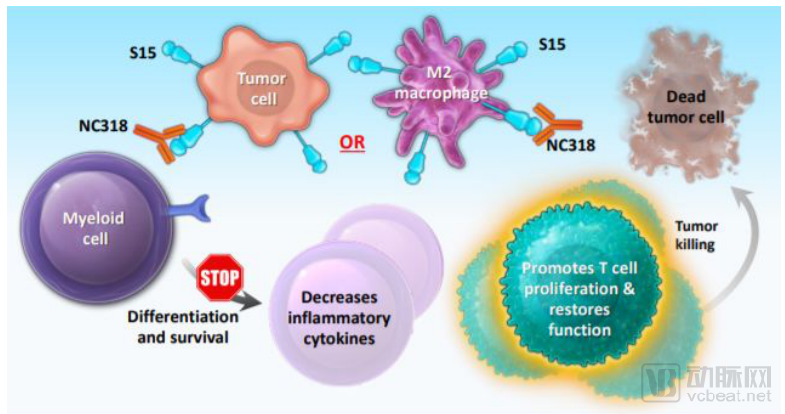
数据来源:NextCure
Halozyme透明质酸酶制剂PEGPH20胰腺癌三期临床失败
美国生物技术公司Halozyme宣布其透明质酸酶制剂PEGPH20在一个叫做HALO-301的胰腺癌三期临床失败
PEGPH20是透明质酸酶的Peg化人源重组蛋白,能够降解透明质酸,这类多糖暂时可逆降解后可以增加生物大分子的扩散吸收,可以让很多需要静脉滴注的药物改成皮下注射
在吉西他滨和ABRAXANE®背景上比较PEGPH20与安慰剂作为晚期胰腺癌一线药物对OS的影响
两组OS分别为11.2和11.5个月、错过试验终点
第一三共糖尿病肾病新药esaxerenone达3期临床终点
第一三共(Daiichi Sankyo)公司宣布,其选择性盐皮质激素受体抑制剂esaxerenone,在治疗早期糖尿病肾病患者的3期关键性试验中,达到了试验的主要终点和次要终点
Esaxerenone(CS-3150)是非甾体类、选择性盐皮质激素受体(MR)抑制剂,MR是一种核受体,在许多心血管疾病和代谢类疾病中都起作用
随机、双盲、含安慰剂对照组的3期临床试验,参与该试验的糖尿病肾病患者接受ARB或ACE抑制剂的治疗
以尿白蛋白与肌酐比率(UACR)为指标,esaxerenone将患者的缓解率(remission rate)提高了22.1%,而安慰剂组中的这一数值为4%,达到了试验的主要研究终点
Cirius Therapeutics NASH新药MSDC-0602K临床2b期结果积极
Cirius Therapeutics公司宣布旗下MSDC-0602K在治疗非酒精性脂肪性肝炎(NASH)患者的2b期试验EMMINENCE中,显著改善患者的肝脏酶水平,血糖控制,以及胰岛素抵抗现象
MSDC-0602K是第二代口服胰岛素敏化剂,较第一代其在调节线粒体丙酮酸载体(MPC)功能同时,最大限度地降低过氧化物酶体增殖物活化受体γ(PPARγ)的直接激动效应
入组402名NASH患者,进行不同剂量的疗效对比
三种不同剂量的MSDC-0602K(62.3 mg,125 mg,250 mg)都显著降低了患者的NAFLD活跃度评分(NAS),分别有33.3%,39.8%和42.6%的患者的NAS评分至少降低了2个点
Scynexis口服抗菌药ibrexafungerp 3期临床达主要终点和关键性次要终点
Scynexis公司宣布,其在研口服抗菌药ibrexafungerp,在治疗外阴阴道念珠菌病(VVC)患者的3期临床试验中,达到试验的主要终点和关键性次要终点
Ibrexafungerp(SCY-078)是一种新型葡聚糖合成酶抑制剂,它将葡聚糖合成酶抑制剂的良好活性与口服和静脉注射给药的潜在灵活性结合在一起
随机、双盲、含安慰剂对照,共有376名症状和体征评分≥4(S&S,评分范围为0至18)的VVC患者入组
与安慰剂组相比,50.5%接受ibrexafungerp治疗的患者在接受治疗10天后达到了临床治愈的标准,即患者的S&S评分达到0分。这一数值显著高于安慰剂组(p=0.001)
武田Ninlaro一线治疗多发性骨髓瘤达3期临床主要终点
武田宣布其蛋白酶体抑制剂Ninlaro(ixazomib)作为一线维持疗法,在治疗未接受过干细胞移植疗法的多发性骨髓瘤(MM)成年患者3期试验达到试验的主要终点
Ninlaro是首款获得FDA批准的口服蛋白酶体抑制剂,它可选择性地结合蛋白酶体的PSMB5亚基,并抑制它的活性
随机、双盲、含安慰剂对照,入组患者为新确诊且未接受过干细胞移植疗法的成年患者在接受初始治疗并获得部分缓解,分别接受Ninlaro或安慰剂的治疗
与安慰剂组相比,接受Ninlaro治疗的患者PFS显示出统计学上的显著改善,达到试验的主要终点
吉利德两款HIV新药展现长期疗效
吉利德宣布,其作为暴露前预防疗法降低男性和变性女性HIV感染风险的Descovy,以及用于治疗初次感染HIV患者的Biktarvy,在3期试验的扩展期研究中,进一步证实了它们的长期有效性和安全性
Descovy是一款复合制剂,含emtricitabine 200mg、tenofovir alafenamide 25mg;Biktarvy较Descovy多了成分bictegravir,这是一款全新的整合酶链转移抑制剂(INSTI)
DISCOVER旨在验证Descovy与已获批的PrEP疗法Truvada相比,能否达到非劣效性标准;Biktarvy试验旨在初治的HIV-1感染成人患者中,分别验证与DTG/ABC/3TC或DTG+Descovy相比,其抑制HIV病毒的有效性
Descovy组HIV感染几率平均为每年0.16/100人,而Truvada组HIV感染几率平均为每年0.30/100人;接受Biktarvy的患者中82%达到HIV-1的RNA水平小于50拷贝/毫升的标准,与对照相比,在抑制病毒复制方面达到非劣效性标准
赛诺菲长效胰岛素达到3期临床终点
赛诺菲宣布其长效胰岛素Toujeo Gla-300在治疗儿童和青少年(6至17岁)1型糖尿病患者的实验中,与Toujeo Gla-100相比,达到主要终点
Toujeo Gla-300是一款长效胰岛素,胰岛素含量是标准的1mL胰岛素的3倍(100单位/ mL),通过刺激外周葡萄糖摄取以及通过抑制肝葡萄糖的产生来实现降低血糖的效果
入组6-17岁、糖化血红蛋白水平在7.5%和11.0之间的1型糖尿病患者中,验证与Toujeo Gla-100相比,Toujeo Gla-300降低HbA1c水平,以及管理血糖波动的有效性
Toujeo Gla-300组实现了对HbA1c水平降低非劣效性这一主要终点,并且该组酮症和严重低血糖症(<54 mg/dL)的发生率都相对更低
百奥泰的阿达木单抗注射液的上市申请获批
百奥泰的阿达木单抗注射液的上市申请(CXSS1800018)正式获得国家药品监督管理局批准,适应症与原研药Humira在中国已获批的适应症相同
是全球首个获批上市的全人源TNF-ɑ单克隆抗体,可特异性地与可溶性人TNF-ɑ结合并阻断其与细胞表面TNF受体p55和p75的相互作用,从而有效阻断TNF-ɑ的致炎作用
以原研阿达木单抗为参照药、按照生物类似药途径研发和申报生产,通过全面的质量相似性研究、非临床相似性研究和临床比对研究
证明了其在质量、安全性和有效性方面与已获准上市的参照药具有高度相似性
新基潜在重磅贫血疗法Reblozyl获FDA批准上市
新基(Celgene)和Acceleron公司联合开发的Reblozyl(luspatercept-aamt)获FDA批准上市,用于治疗输血依赖性β地中海贫血症(beta thalassemia)患者的贫血症状
Reblozyl是一种可溶性融合蛋白,由IgG1的Fc结构域与活化素受体IIB的细胞外结构域融合而成。能够作为TGF-β的配体陷阱,防止TGF-β激活Smad2/3信号通路,进而促进晚期红细胞的分化和成熟
入组需要输血的β地中海贫血患者,按照2:1随机分组,评估luspatercept+最佳支持治疗(BSC)与安慰剂+BSC的疗效和安全性差异,主要终点是红细胞反应。
21%的患者的输血负担与基线相比降低超过33%,显著优于接受安慰剂治疗的对照组(4.5%,p<0.0001)
Reblozyl的作用机制
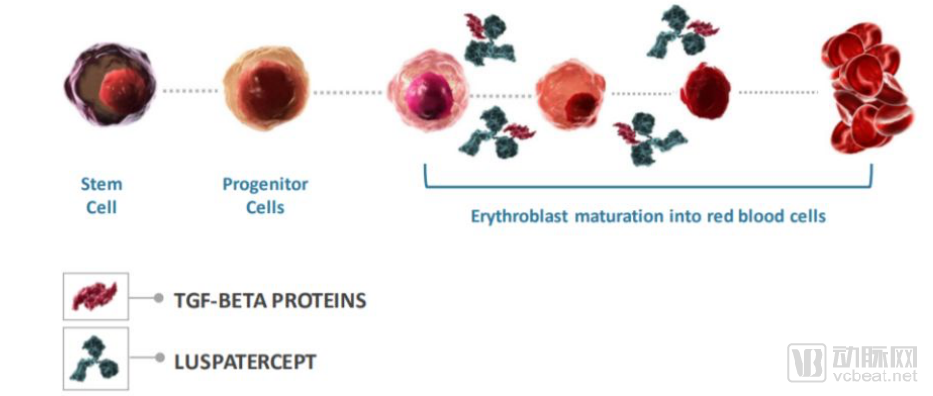
数据来源:ACCELERON
❖ Inovio Pharmaceuticals公司宣布,其在研T细胞激活免疫疗法INO-5401,与免疫激活剂INO-9012,联合再生元与赛诺菲公司合作开发的PD-1抑制剂Libtayo(cemiplimab)构成的组合疗法,在治疗新确诊的胶质母细胞瘤患者的1/2期临床试验中,使80%具有甲基化MGMT基因的患者达到6个月的无进展生存期
❖再生元公司宣布,中期数据分析表明,与赛诺菲共同开发的PD-1抑制剂Libtayo(cemiplimab)作为单药疗法,在一线治疗晚期NSCLC患者的3期临床试验中表现出显著优于化疗的良好疗效。目前,Libtayo正在两项3期临床试验中作为单药,或与化疗联合治疗晚期NSCLC患者
❖ Constellation Pharmaceuticals公司宣布,其选择性BET抑制剂CPI-0610在名为MANIFEST的2期临床试验中,展现出治疗骨髓纤维化患者良好的临床活性。该试验主要针对未接受过JAK抑制剂治疗的患者和对已上市疗法ruxolitinib产生耐药性或不耐受的患者
❖ 阿斯利康公布评估靶向抗癌药Calquence(acalabrutinib)一线治疗慢性淋巴细胞白血病Ⅲ期ELEVATE-TN研究的首批数据。该研究在中期分析时已达到了主要终点,这是继今年5月公布的ASCEND研究之后,Calquence治疗CLL的第二项关键性III期研究提前达到主要终点
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。