
# 热门搜索 #
【ICH背景下的药物研发】一波未平一波又起的缬沙坦事件,NMPA、FDA、EMA对亚硝胺杂质如何管理?
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持2019年9月13日,美国食品药品监督管理局(FDA)发布声明称,一些雷尼替丁药物(包括Zantac等为人熟知的治疗胃溃疡药品)含有一种称为N-亚硝基二甲胺(NDMA)的亚硝胺杂质。同日,欧洲药品管理局(EMA)的执行董事也发表声明,要求人类药物委员会(CHMP)提供指导如何避免人用药物中的亚硝胺的方法,并表示在一家公司的吡格列酮和雷尼替丁样品中检测到亚硝胺杂质。目前,FDA和EMA已经开始在美国和欧盟范围内对雷尼替丁进行审查。
这次在雷尼替丁中发现的杂质NDMA并不让人感到陌生,它正是一年前引发华海缬沙坦巨大风波中的主角。
2018年,华海因生产的缬沙坦原料药中发现杂质NDMA,引发EMA和FDA调查。7月5日EMA发布召回公告,表示获知华海川南工厂生产的缬沙坦中检测出NDMA杂质,随机抽检杂质含量为3.4-122 ppm,平均值为66.5ppm。根据ICH(人用药品注册技术要求国际协调会议)指导原则M7为限制潜在致癌风险而对药物中DNA活性(诱变性)杂质进行的评估和控制,认为该杂质水平需引发警惕。FDA则于7月底至8月初对华海川南工厂进行现场检查,9月28日将其列入进口禁令66-40。
根据FDA警告信,笔者梳理出一条华海缬沙坦NDMA问题的时间线,见下表
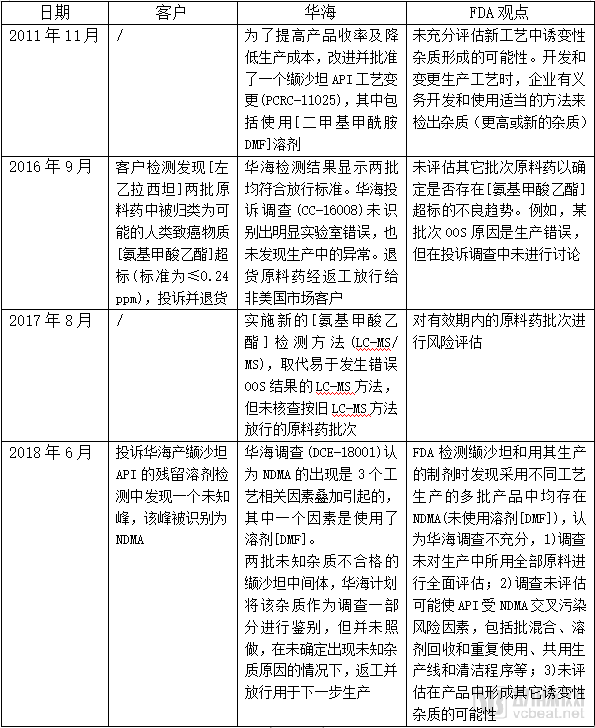
[ ]:FDA警告信中隐藏信息,参考华海药业的翻译文件补齐
华海表示,发现NDMA杂质时,各国监管部门尚未对该杂质制定可接受控制限度的行业标准,其缬沙坦现行工艺分别于2012年、2013年经过了EMA和FDA批准,符合法规标准。
但FDA提醒,通用行业规范可能并不总与CGMP要求保持一致,企业需要对其生产药品质量负责。ICH M7提示,变更原料药生产工艺时,变更评估要确定是否会导致任何新的诱变杂质或已知诱变杂质更高的接受标准。FDA与制造商密切合作,解决产品中的杂质问题,增加紧缺药物供应。
亚硝酸化合物
在2018年6月之前,NDMA和NDEA不在已确定的沙坦类药物杂质中,因此常规测试未检测到。有些沙坦含有一种特殊的环结构(四唑环),在某些条件下,当使用某些溶剂、试剂和原材料时,合成过程中可能生产形成亚硝胺杂质。此外,当制造商在制造过程中使用了受污染的设备或试剂也会导致药物中存在杂质。没有四唑环的其他类药物,如阿齐沙坦、依普罗沙坦和替米沙坦,暂不涉及此风险。
NMDA事件给华海制药带来巨大影响,2017年度,华海药业缬沙坦原料药销售收入为3.28亿元,缬沙坦制剂销售额为2043万美元。2018年美国停止进口华海生产的缬沙坦原料药以及用这些原料药制成的制剂,欧盟也禁止华海药业浙江临海川南工厂产品入境。华海除停产停供带来的直接损失外,还将面临产品召回,客户赔偿以及后续可能发生的诉讼费用。
同时受到震荡的还有超过百亿市值的沙坦类药物市场。华海之后,由于Aurobindo、Mylan、Sandoz、Teva等其他公司成品中也发现了NMDA或NDEA,引发了上千批次缬沙坦、氯沙坦、雷尼替丁的召回,造成关键药物(包括缬沙坦和氯沙坦药品)短缺,迫使FDA加快和优先审查能缓解短缺的新药或仿制药申请。2019年3月,FDA优先审查和批准了印度制药公司Alkem Laboratories Limited的仿制药Diovan(缬沙坦)。FDA评估了该公司的制造工艺,确保他们使用了适当测试方法来证明获批缬沙坦产品不包含NDMA或NDEA,不存在其他亚硝胺杂质形成的已知风险。
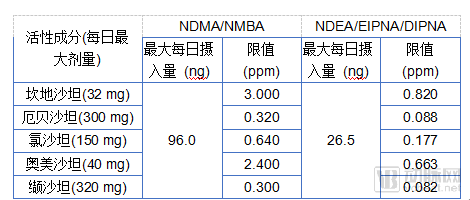
NDMA和NDEA(N-亚硝基二乙胺)都是亚硝胺杂质,经动物试验确定为动物致癌物,目前被列为人类可疑遗传毒性致癌物。EMA引用一篇综述评估了亚硝胺杂质可能导致的最高癌症风险(根据动物研究推断):在10万名患者中,每天以最高剂量服用华海缬沙坦(按杂质平均含量66.5ppm计算),6年后,这些患者中增加了22例可能因NDMA导致的癌症患者;每天以最高剂量服用4年,可能因NDEA导致的癌症患者人数为8名。
2019年1月31日,EMA建议生产沙坦降压药的公司审查其生产工艺,以避免产生亚硝胺杂质,并根据现行国际准则,为NDMA和NDEA设定了过渡期临时限值。通过基于动物研究中每种杂质的最大每日摄入量(NDMA:96.0ng,NDEA:26.5ng),除以每种活性物质的最大日剂量,计算得到限值(见下表)。
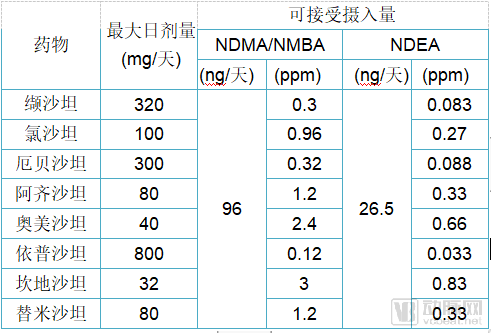
随后,FDA又在某些氯沙坦产品中发现了新亚硝胺杂质,即N-亚硝基-N-甲基-4-氨基丁酸(NMBA)。根据初步评估,暴露于NMBA的患者患癌症的风险增加比例与暴露于NDMA的患者相似,但低于暴露于NDEA的风险。2019年2月28日,FDA发布了血管紧张素Ⅱ受体阻滞剂(ARBs)中NDMA、NDEA和NMBA杂质临时限值(见下表)
欧洲药品和保健质量管理局(EDQM)网站上可查阅欧盟官方药品检验实验室制定的检测沙坦类药物NDMA和NDEA方法*,并可基于这些方法开发和验证适用于其他API中亚硝胺杂质的分析方法。
EMA于2019年9月19日和26日发布通告要求人用药上市许可持有人(MAH)在6个月内审查其药物中存在的亚硝胺污染风险,如在药物中检测到亚硝胺,则MAH必须及时通知EMA,以便采取适当的监管措施。优先考虑高风险产品,在3年内解决亚硝胺污染问题。FDA也发布了沙坦类和雷尼替丁等药物中亚硝胺杂质的检测方法。
2019年1月2日,中国国家药典委员会发布“关于缬沙坦国家标准修订稿的公示(第二次)”,拟在中国药典2015年版二部第1547页缬沙坦中增加N-亚硝基二甲胺和N-亚硝基二乙胺限度,分别不得超过0.3ppm和0.08ppm。2019年8月2日,中国国家药典委员会再次发布“关于缬沙坦、厄贝沙坦和替米沙坦国家药品标准修订草案的公示”[增订]【生产要求】,以应对生产工艺进行评估以确定形成遗传毒性杂质N-亚硝基二甲胺和N-亚硝基二乙胺等的可能性。公示提出,必要时,采用适宜的分析方法对产品进行分析,以确认N亚硝基二甲胺和N-亚硝基二乙胺等的含量符合我国药品监管部门相关指导原则或 ICH M7指导原则的要求。
即将在2019年12月1日生效的新版《中华人民共和国药品管理法》,其第二十八条指出国家药品标准是国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准。国务院药品监督管理部门核准的药品质量标准高于国家药品标准或没有国家药品标准,应按照经核准的药品质量标准执行。2018年11月20日,国家药典委员会制订《国家药典委员会药品标准制修订研究课题管理办法》(试行),鼓励企业参与药品标准制修订,以后国家药品标准来源之一将会是药品生产企业的注册标准,因为生产企业对其产品的基础研究、生产工艺是非常熟悉和了解的,可以积极配合提高国家药品标准,提升药品质量。
缬沙坦事件后,EMA要求MAH和制造商考虑以下事项:
• 所用试剂、溶剂、催化剂和起始材料、形成的中间体、杂质和降解的组合,在原料药合成过程中是否存在亚硝胺形成的风险?
• 是否存在亚硝胺污染的潜在风险(来自回收材料,如溶剂、试剂和催化剂、设备、降解、起始材料或中间体)?
• 在成品生产和/或整个保质期内的储存过程中,是否存在生成亚硝胺的可能性?
MAH和制造商应通过测试相关原材料、中间体、原料药或成品的代表性样品进行验证,测试的批次/样品数量应科学合理。目前,已知药物中亚硝胺杂质来源途径:
1、 原料药加工过程中,某些加工条件下,某些原料、起始原料和中间体存在,可能会导致亚硝胺的生成,并且这些杂质后续步骤中又未完全清除。存在仲胺或叔胺时使用亚硝酸钠(NaNO2)或其他亚硝酸盐是形成亚硝胺的潜在原因,目前大多数确认的原料药亚硝胺污染案例中,亚硝酸盐和胺被用于同一步骤。但这里还有一种可能,如果亚硝酸钠在某一步的制备过程中被最为了反应试剂来使用,尽管经过了广泛的纯化操作,仍有参与被带入后续步骤,与胺反应生成亚硝胺杂质。由于不能完全排除亚硝酸盐从一个步骤到下一个步骤的转移,如果合成的任何步骤中存在胺,使用亚硝酸钠(或其他亚硝酸盐来源)的所有过程都应考虑产生亚硝胺杂质的风险。
2、 在生产过程中使用受污染的原料后,回收溶剂、试剂和催化剂有生成亚硝胺风险。回收材料(如溶剂、试剂和催化剂)通常外包给第三方,在某些情况下,第三方回收机构未收到关于其处理的材料的足够具体信息,并在非专用设备中执行常规回收过程。如果在客户之间没有充分清洁设备,或者没有采取避免亚硝胺生成的预防措施,就可能导致来自不同来源或过程的溶剂、试剂和催化剂的交叉污染。
3、 受污染的起始材料,包括原料或中间体,带来亚硝胺。
4、 起始材料、中间体和药物的降解,包括与残留NaNO2或其它亚硝化剂反应引发的降解。在成品配制或贮存期间也可能发生这种情况。
5、使用特定包装材料。一MAH观察到吸塑包装中的成品发生亚硝胺污染。假设含有硝化纤维印刷材料的封口铝箔能够与油墨中的胺反应生成亚硝胺,并在特定包装过程中转移至产品中。
作者简介

参考资料
https://www.fda.gov/news-events/press-announcements/statement-alerting-patients-and-health-care-professionals-ndma-found-samples-ranitidine
https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/zhejiang-huahai-pharmaceutical-566685-11292018
https://www.ema.europa.eu/en/news/ema-provide-guidance-avoiding-nitrosamines-human-medicines
https://www.ema.europa.eu/en/medicines/human/referrals/angiotensin-ii-receptor-antagonists-sartans-containing-tetrazole-group
https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-information-nitrosamines-marketing-authorisation-holders_en.pdf
http://www.chp.org.cn/view/ff80808167f36c8401680c3d64812849?a=BZHXYP
http://www.chp.org.cn/view/ff8080816c2d76c5016c51c48ab54767?a=BZHXYP
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。