
# 热门搜索 #
2019CSCO |多瘤种布局取得新突破,君实生物最新研究成果亮相CSCO学术年会
{{detail.short_name}} {{detail.main_page}}
{{detail.description}} {{detail.round_name}} {{detail.state_name}}
 提供支持
提供支持近日,君实生物宣布公司自主研发的抗PD-1单抗特瑞普利单抗(商品名:拓益)针对膀胱尿路上皮癌和非小细胞肺癌两项适应症的II期研究,在第22届全国临床肿瘤学大会暨2019年CSCO学术年会上进行了数据分享,研究取得了骄人的阶段性成果。这是君实生物向多瘤种布局的又一令人振奋的新进展。
每年的CSCO学术年会是一场盛大的学术盛宴,其以规格高、权威性强、研究成果新等特点,集结国内顶级肿瘤领域专家进行学术交流,有力推动学科发展,今年的主题为“创新精准研究,探索智慧医疗”。
膀胱尿路上皮癌是泌尿外科最常见的恶性肿瘤之一,严重威胁患者生存时间和质量。在中国,针对标准化治疗失败的晚期尿路上皮癌患者的治疗手段非常有限,以抗PD-1单抗为代表的免疫治疗的崛起,给这些患者带来了希望。其中,特瑞普利单抗用于系统性治疗失败的转移性尿路上皮癌的POLARIS-03研究,取得了令人欣喜的数据结果。该研究也曾在今年的ASCO学术年会上发表,受到国际学界的关注和认可。
POLARIS-03研究是一项多中心、开放的Ⅱ期注册研究,由北京大学肿瘤医院郭军教授和上海交通大学医学院仁济医院黄翼然教授共同牵头,旨在评估特瑞普利单抗单药治疗经标准治疗失败后的晚期局部进展或转移性膀胱尿路上皮癌患者的有效性和安全性。研究计划纳入150名受试者,目前已完成全部患者入组。

郭军教授在创新药物临床研究数据专场
在本次会议中,研究的更新数据再次引发关注。研究显示,截至2019年9月5日,在106例可评估患者中,特瑞普利单抗总体人群的客观缓解率(ORR)为26.4%,疾病控制率(DCR)为50.9%,平均起效时间为9.03周。
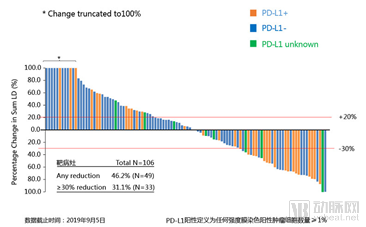
靶病灶从基线至最佳疗效的变化(N=106)
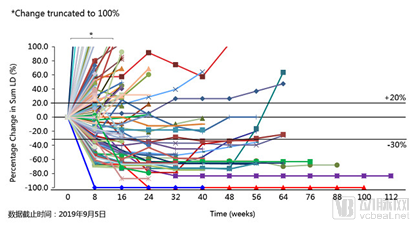
可评估患者中,靶病灶随时间变化(N=106)
PD-L1表达阳性患者免疫治疗有效率高达42.4%,是目前国内外PD-1/PD-L1单药治疗公开数据中最高的。
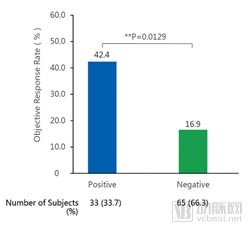
根据PD-L1表达状态分析ORR
北京大学肿瘤医院郭军教授表示,既往国外也进行了转移性尿路上皮癌一线化疗失败后接受免疫检查点抑制剂单药治疗的临床研究,其客观缓解率绝大多数在20%左右,相较而言,POLARIS-03的临床疗效有了显著提升,让我们中国专家感到自豪,也对未来的研究和应用前景充满信心。这同时说明君实生物自主研发的抗PD-1单抗的临床研发实力已经可以比肩国际水平。
肺癌是中国发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)占肺癌总体的85%以上,且大部分初诊时已是晚期。这其中,EGFR突变阳性的NSCLC患者比例较高。此类患者一线治疗往往会使用EGFR-TKI,在治疗失败后,后续治疗选择极其有限。多项研究数据表明,免疫单药治疗EGFR突变患者的疗效不佳,治疗需求远远未被满足。
为了突破这一难题,改善治疗策略,同济大学附属上海市肺科医院周彩存教授牵头国内首个针对EGFR突变阳性NSCLC的临床研究。该研究联合应用特瑞普利单抗和化疗药物培美曲塞、卡铂,Ⅱ期临床研究结果也在今年的世界肺癌大会(WCLC)中以口头报告的形式公布,这是特瑞普利单抗在肺癌领域的首次亮相。

周彩存教授在创新药物临床研究数据专场
研究纳入40例患者,客观缓解率(ORR)为50%,疾病控制率(DCR)达到87.5%;中位缓解持续时间(DoR)7.0个月;整体人群的中位无进展生存期(PFS)为7.0个月。亚组分析看到PD-L1阳性患者,ORR为60%,中位PFS达到8.2个月。
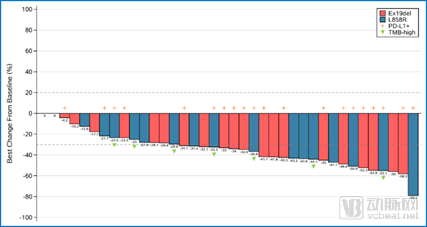
有效性结果-ITT人群
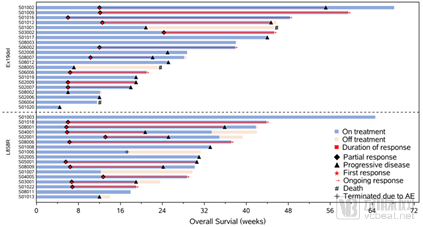
疗效及缓解持续时间
研究牵头人周彩存教授表示,相比既往单纯化疗30%左右的ORR和4个月左右的PFS,免疫联合化疗治疗能起到协同作用,使疗效大大提高,为EGFR突变NSCLC患者提供了新的治疗思路。Ⅱ期的数据给了我们勇气进一步进行Ⅲ期临床研究,期待能有更让人欣喜的结果。此次公布的Ⅱ期临床研究也是国内首个在EGFR突变阳性NSCLC领域开展的研究,目前君实生物在这一领域已走在前列,也希望未来能造福更多中国肺癌患者。
作为第一个在国内获批的国产原研抗PD-1单抗,拓益在去年上市之后,已逐渐成为本土PD-1单抗的领头羊。
包括目前已获批的黑色素瘤,拓益至今已在中国、美国、新加坡等国家和地区开展了覆盖鼻咽癌、尿路上皮癌、乳腺癌、肺癌、肝癌、食管癌等14个瘤种的30多项临床研究,在多个瘤种的临床试验中取得了卓越的结果。
同时,为了在抗PD-1单药疗效有限的适应症上取得进一步突破,君实生物还开展了拓益与传统疗法、创新药物/疗法的联合治疗探索。在君实生物正在进行的14个关键注册临床试验中,绝大多数是联合疗法,部分已取得突破性进展。如特瑞普利单抗联合抗血管生成药物阿昔替尼对抗亚洲人群中高发的黏膜黑色素瘤,ORR达到51.7%(irRECIST标准),相较以往不超过20%的ORR,结果远超预期,有望成为晚期黏膜黑色素瘤的一线治疗新标准,研究成果于近期荣登国际著名期刊《临床肿瘤学杂志》(JCO)。此外,由君实生物自主研发的全球首个治疗肿瘤抗BTLA阻断抗体与PD-1单抗的联合治疗有望成为全球领先的免疫联合疗法。
君实生物的多瘤种布局正在不断创造新的纪录,郭军教授说:“我相信一个好的产品,需要具备持续的疗效,为患者带来优越的生存获益,以及可及的价格。随着临床试验地不断进行,特瑞普利单抗将会为未来中国的免疫治疗提供更多的循证医学证据。”
关于拓益(特瑞普利单抗注射液)
拓益(特瑞普利单抗注射液)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持。2018年3月,国家药品监督管理局正式受理了本品的上市注册申请,并将其纳入优先审评审批品种予以加快审评审批。本品的临床试验结果显示,治疗既往接受全身系统治疗失败的不可切除或转移性黑色素瘤患者的客观缓解率达17.3%,疾病控制率达57.5%,1年生存率达69.3%。本品的上市批准对解决我国肿瘤患者临床用药选择具有积极意义。
拓益自2016年初开始临床研发,至今已在中、美等多国开展了覆盖14个瘤种的30多项临床研究,积极探索本品在鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、乳腺癌等适应证的疗效,与国内外顶尖创新药企的联合疗法合作也在进行当中,期待让更多中国患者获得国际最先进水平的肿瘤免疫治疗。
关于君实生物
君实生物(NEEQ:833330,HKEX:01877)于2012年12月由多名毕业于中美两国知名学府、具有丰富跨国科技成果转化及产业经验的团队创办。
君实生物以开发治疗性抗体为主,专注于创新单克隆抗体药物和其他治疗性蛋白药物的研发与产业化。具有丰富的在研产品管线,包括17个创新药,2个生物类似物,是第一家获得抗PD-1单克隆抗体NMPA上市批准的中国公司,国内首家就抗PCSK9单克隆抗体和抗BLyS单克隆抗体取得NMPA的IND申请批准的中国公司,并取得了全球首个治疗肿瘤抗BTLA阻断抗体在美国FDA的IND申请批准。目前在全球拥有超过一千名员工,分布在美国旧金山和马里兰,中国上海、苏州、北京和广州。
如果您想对接动脉网所报道的企业,请填写表单,我们的工作人员将尽快为您服务。