我们时常会在一些艰难的治疗领域中,听说药物管线临床研究失败,甚至被放弃的消息。
放弃一款已经耗费了大量资源的管线,对于任何药企来说都是一个艰难的决定。但有时挫折只是成功路上必经之处。总有些人怀揣着信念,一次又一次的被监管机构退回,再一次又一次的提交。
2021年3月,AVEO Pharmaceuticals的新药FOTIVDA(tivozanib)获得美国FDA的批准。而在此之前,AVEO分别在2013年和2019年两度提交tivozanib的上市申请,但均被美国FDA拒绝,颇有些三顾茅庐的味道。

AVEO总部位于美国马萨诸塞州剑桥市,前身是基因路径制药公司——GenPath Pharmaceuticals,于2005年改为Aveo Oncology,作为一家专注于肿瘤学的生物制药公司,致力于为提供癌症患者提供更好生活的药物。
成立于2001年的生物制药公司AVEO早在 2010年3月18日完成其首次公开募股。到目前为止,AVEO已筹集到总共5.536亿美元资金用于公司管线产品研发和商业化。
华人女科学家秦玲玲(Lynda Chin)是AVEO的联合创始人。秦博士15岁时随家人从中国移民到美国,在布朗大学以优异成绩获得学士学位后,就读于阿尔伯特·爱因斯坦医学院并获得医学博士学位。在癌症领域有着多年行业经验和丰富的知识储备。
秦博士在肿瘤基因组学和个性化癌症医学等领域取得了多项科学发现。2011年,秦博士加入德克萨斯大学MD安德森癌症中心,担任有史以来第一个基因组医学系主任。在此之前,秦博士是Dana-Farber癌症研究所应用癌症科学研究的科学主任。 她还是TCGA基因组数据分析联盟的联合首席研究员。TCGA项目专注于挖掘和翻译复杂的基因组数据,以确定新的癌症靶点和诊断生物标志物。
作为一位出色的科学家的同时,秦博士还是一位成功的商人。除了AVEO以外,她还创立了Metamark Genetic,一家癌症诊断公司,指导早期癌症患者的管理,包括黑色素瘤和前列腺癌。
肾癌是泌尿系统中恶性度较高的肿瘤,也是最常见的肿瘤之一,约占成人恶性肿瘤的2%~3%,占成人肾脏恶性肿瘤的80%~90%。AVEO在肾癌领域辛勤耕耘十余年。
血管内皮生长因子(VEGF)是人体血管发育和血液及淋巴管功能的主要调节因子,是目前发现的最重要的促进肿瘤血管形成的因子,可以通过抑制该指标使肿瘤血液供应减少,从而抑制肿瘤的生长。
目前有五种已知的VEGF配体(A,B,C,D,PLGF)和三种VEGF受体(1,2和3),每种配体对三种VEGF受体表现出不同但重叠的结合谱。
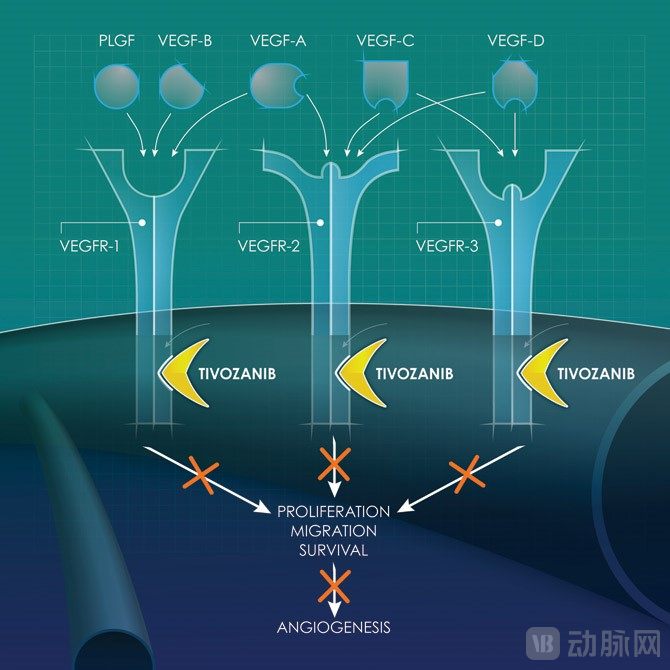
每种受体都在癌症血管生成中起着重要作用:VEGF受体1对于调节内皮细胞存活和血管形态发生至关重要;VEGF受体2是内皮细胞增殖和迁移的主要受体;而VEGF受体3促进内皮发芽和血管网络形成。所以为了最佳地抑制VEGF信号通路,三种VEGF受体都必须受到有效阻断。
AVEO的主要候选药物tivozanib是一种分化的血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂(TKI),而且它对VEGFRs(1、2和3)都有抑制效果,具有长半衰期,能够提高功效和耐受性。通过tivozanib对血管内皮生长因子受体(VEGFR)酪氨酸激酶的抑制作用,使血管内皮生长因子受体的功能受到抑制而发挥不了作用,从而阻断血管的生成,使肿瘤缺少血液供给而死亡。
FOTIVDA是第一个也是唯一一个被批准用于晚期肾癌或肾细胞癌(RCC)的治疗方法。 FOTIVDA适用于在两次或两次以上全身治疗后复发或难治性晚期肾细胞癌(RCC)的成年患者。 临床前研究表明,tivozanib在阻断VEGF信号通路的同时,还可以最大限度地减少脱靶毒性。

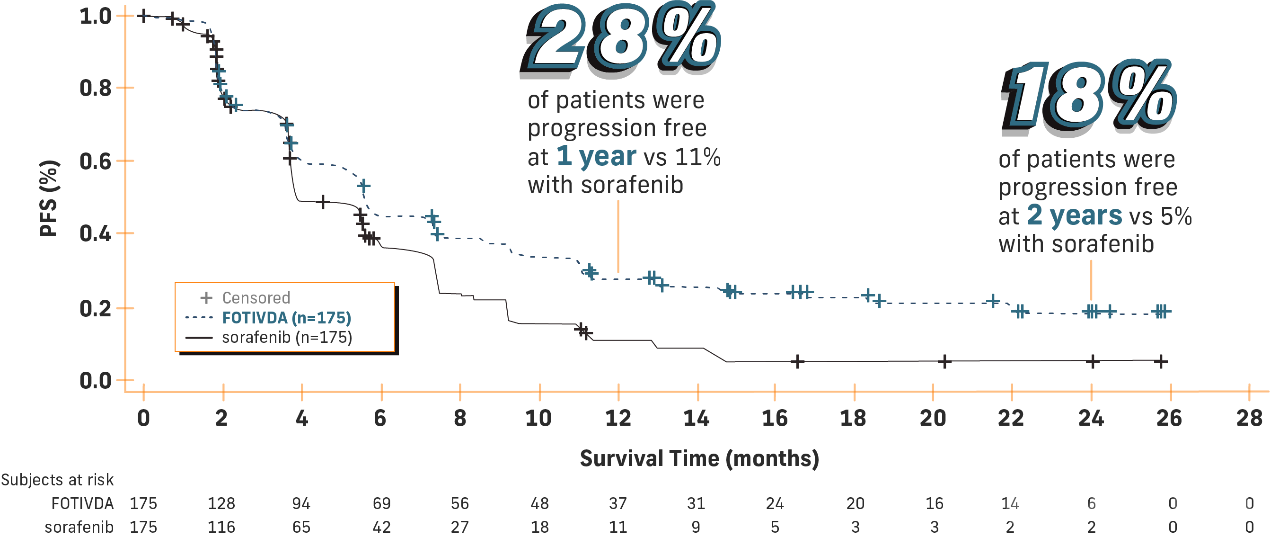
tivozanib的有效性和安全性在对复发或难治性晚期肾癌患者(共350人)的临床研究中得到了证实。这些药物包括免疫疗法和其他治疗方法,在试验期间,随机选择175人服用tivozanib,175人选择服用索拉非尼。
结果显示,服用tivozanib的患者在限定时间内肿瘤没有增长扩散的人数比例为44%;而服用索拉非尼的患者在同样时间内肿瘤没有增长扩散的人数只有28%。服用tivozanib(18%)的患者中,肿瘤变小的人数是服用索拉非尼(8%)患者的两倍。相比于服用索拉非尼的患者有65%的癌症得到了有效控制,在服用tivozanib的患者中有73%的癌症得到了有效控制。
2021年3月AVEO的新药FOTIVDA获得美国食品和药物管理局(FDA)的批准,用于治疗成年患者在两种或两种以上全身性治疗后复发或难治性晚期肾细胞癌(RCC)。而且,在此之前FOTIVDA于2017年8月在欧盟、挪威。新西兰、冰岛等已获得批准,用于晚期RCC成年患者。
虽然如今tivozanib已经在欧美等全球多个国家和地区成功获批上市(商品名FOTIVDA),但其实FOTIVDA的上市之路走得十分曲折。AVEO在这条路上走了近十余年,期间频频被FDA驳回上市申请。
AVEO早在2013年就向FDA提交了VEGF受体抑制剂tivozanib用于肾癌的申请。但是,FDA专家小组对AVEO的试验产生了质疑,原因是患者服用索拉非尼的生存期比使用tivozanib的生存期更长,并最终导致AVEO的申请并没有被通过。这个结果甚至引起AVEO的股价暴跌,还失去了Astellas这个重要合作伙伴。
但在被FDA拒绝之后,AVEO并没有放弃对tivozanib的研究和试验。AVEO又开展了TIVO-3的开放标签III期研究,比较tivozanib和索拉非尼用于RCC的疗效,并宣称研究达到了主要终点,证明无进展生存时间(PFS)有显著改善。但遗憾的是,2019年11月FDA对AVEO提交的数据进行梳理之后,再次拒绝了AVEO 关于VEGF 受体抑制剂tivozanib的申请。
虽然在FDA屡屡受挫,但是tivozanib获得了欧盟的认可,于2017年获EMA批准,商品名FOTIVDA。直到2021年2月22日,AVEO宣布FOTIVDA最终获得美国FDA的批准,之前的所有努力和坚持都没有白费,终于迎来了收获的一天。
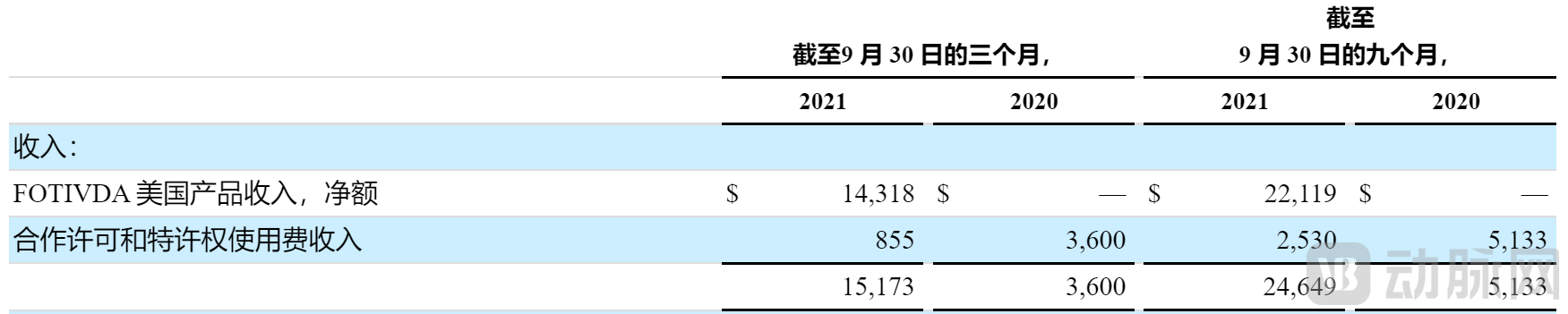
从FOTIVDA在美国上市以来,仅2021年前三个季度就为AVEO带来巨额收入,未来定将成为AVEO资金流入的一大重要组成部分。
虽然FOTIVDA(tivozanib)已经获得FDA的批准在美国上市,用于治疗晚期RCC成年患者,AVEO仍继续在RCC和其他适应症的免疫肿瘤学组合中开发FOTIVDA,并且在临床开发中还有其他几个研究项目。
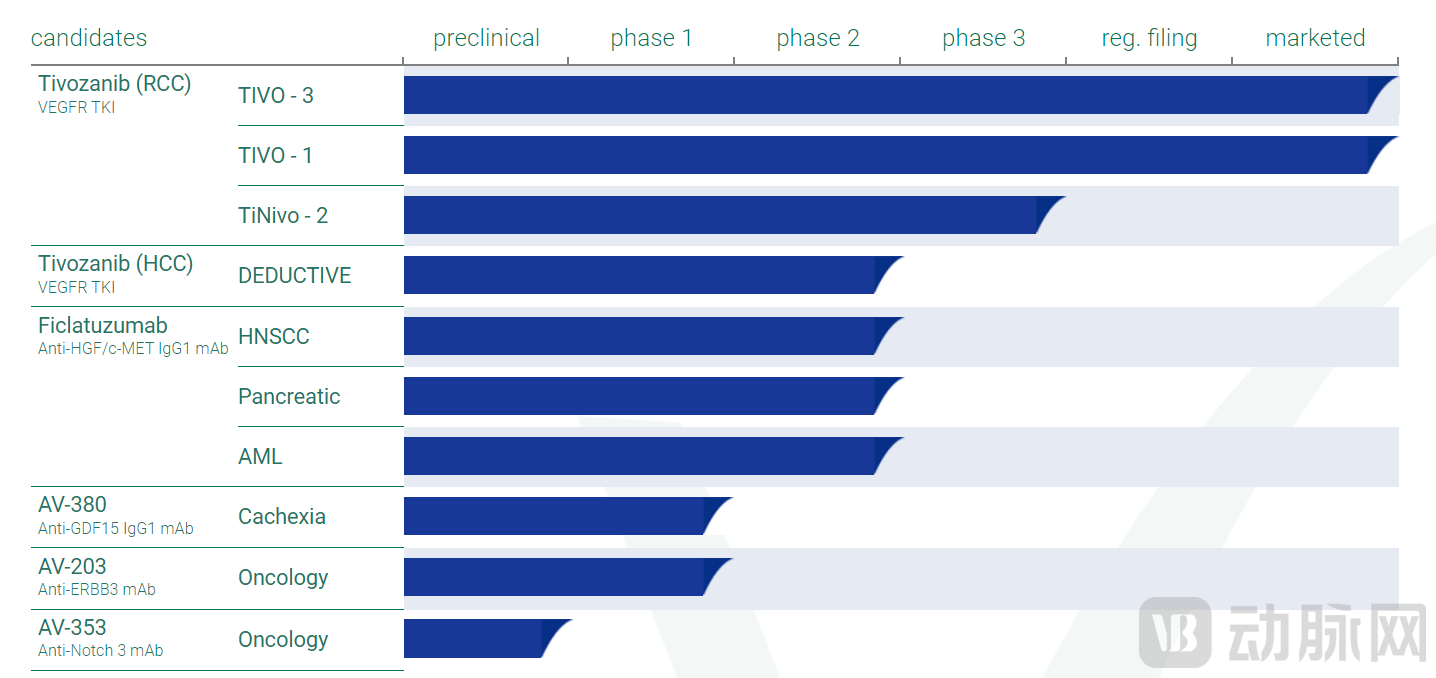
Ficlatuzumab(以前称为AV-299)是一种有效的肝细胞生长因子(HGF)免疫球蛋白G1(IgG1)抑制性抗体,2021年9月AVEO宣布美国食品和药物管理局(FDA)已授予ficlatuzumab快速通道指定(FTD),用于治疗复发或复发性头颈部鳞状细胞癌(R/R HNSCC)患者。
AVEO的候选产品线还包括AV-380(抗GDF15 IgG1 mAb),AVEO此前曾披露FDA接受了AV-380的研究性新药申请,并启动了一项1期临床试验,用于潜在治疗癌症恶病质。AV-380 是 AVEO 首款靶向GDF15 (生长分化因子 15)的高效人源化抑制性 IgG1 抗体。临床前数据显示,抑制GDF15导致从分解代谢转向合成代谢,这表明AV-380抑制GDF15可能逆转恶病质的影响。
除此之外,AVEO的早期产品还包括AV-203(抗ErbB3 mAb)和AV-353(抗Notch 3 mAb),也都是肿瘤治疗领域的单克隆抗体。
AV-203是一种临床阶段的ErbB3抑制性抗体候选物,旨在抑制配体依赖性ErbB3的信号传导。ErbB3是一种常在许多人类癌症中表达的受体。 AVEO之前完成了晚期实体瘤患者AV-203的1期开放标签剂量递增研究,在这项研究中,发现AV-203总体上是安全的,并且耐受性良好,其早期活性信号与临床前数据一致,表明heregulin或neuregulin(唯一已知的ErbB3配体)有可能作为预测AV-203抗肿瘤活性的生物标记物。
AV-353是AVEO针对Notch 3的强效、选择性、高亲和力抑制性抗体。Notch 3信号通路在细胞间通讯中很重要,涉及在整个生命周期中控制多个细胞分化过程的基因调控机制。科学文献已经将Notch 3受体途径与多种疾病联系起来,包括癌症,心血管疾病和神经退行性疾病。
AVEO致力于发现、开发和商业化靶向癌症疗法。为了支持这些努力,公司一直保持与其他制药和生物技术公司的合作,这些公司与AVEO对肿瘤药物开发的愿景相同。
2015年12月,AVEO签订了独家许可协议,授予欧洲公司EUSA Pharma 使用tivozanib治疗晚期肾细胞癌(RCC)的权利。 在两家公司的共同努力下,2017年FOTIVDA在欧洲获批用于治疗RCC成年患者。
2022年1月NiKang Therapeutics和AVEO Oncology宣布达成临床试验合作和供应协议,以评估HIF2α抑制剂NKT2152和FOTIVDA联合用于治疗晚期肾细胞癌。根据协议条款,NiKang将赞助该试验,AVEO将共同资助该试验。两家公司都将免费提供各自的药物。两家公司将成立联合开发委员会,以监督此次合作。
2022年2月 AVEO宣布与靶向放射疗法开发的领导者Actinium Pharmaceuticals达成合作关系,以开发和研究一流的抗体放射性偶联物(ARC) 靶向ErbB3。Actinium将利用其AWE技术平台和广泛的放射治疗技术诀窍,将AVEO的ErbB3靶向抗体之一与有效的α-发射放射性同位素Actinium-225(Ac-225)偶联。
AVEO的战略是将其资源集中在北美候选产品的开发和商业化上,同时利用合作伙伴关系来支持其他地区的开发和商业化,把自身产品的研发和商业相结合。








 提供支持
提供支持