今日,传奇生物BCMA CAR-T产品西达基奥仑赛(cilta-cel)的生物制品许可申请 (BLA)已获FDA批准,用于治疗成人复发/难治性多发性骨髓瘤(r/r MM)。这是中国首个获FDA批准的CAR-T产品,也是全球第二款获批的靶向BCMA的CAR-T疗法。传奇生物的cilta-cel商品名为 Carvykti,据悉定价为 46.5 万美元,略高于来自 BMS 的同靶点 CAR-T 疗法 Abecma,后者定价为 41.95 万美元。
前不久在BCMA CAR-T赛道上才刚传出了好消息,信达生物与驯鹿医疗共同宣布,美国FDA已正式授予两家公司共同开发的全人源自体B细胞成熟抗原(BCMA)嵌合抗原受体自体T细胞(CAR-T)注射液孤儿药资格认定,用于治疗复发/难治性多发性骨髓瘤。
cilta-cel的在美获批,标志着国产新药继PD-1后再次出海成功,同时也让人们再次将目光聚焦在BCMA靶点上。目前,BCMA赛道上还有哪些有力竞争者?他们背后是哪些国内外的创新企业在砥砺前行?让我们来一探究竟。
BCMA靶点与多发性骨髓瘤
BCMA是一种跨膜糖蛋白,它属于肿瘤坏死因子(TNF)受体超家族,又被称为TNFRSF17或CD269。根据研究显示,BCMA在B细胞的增殖和存活中起关键作用,主要在浆细胞和成熟B淋巴细胞中表达。目前,科学证据已表明,BCMA在多发性骨髓瘤中存在过度表达,并呈现随着疾病加重而表达增加的特点,因此,BCMA可谓是治疗多发性骨髓瘤的理想靶点。
多发性骨髓瘤(MM)是一种克隆性浆细胞异常增殖的恶性疾病,同时也是仅次于非霍奇金淋巴瘤的第二常见血液恶性肿瘤。对于初治的多发性骨髓瘤患者,常用的一线治疗药物包括蛋白酶体抑制剂、免疫调节类药物及烷化剂类药物。但是,这类一线治疗一般只能使大部分患者的病情稳定在3-5年,对于治疗有效的大多数初治患者来说,在经过疾病稳定期后,极有可能进入复发、难治阶段,多发性骨髓瘤因此被打上了“高复发率”、“无法治愈”的标签,而对这一疾病领域的药物研发也亟需破局。
BCMA靶点的出现,为变革复发/难治性多发性骨髓瘤疗法带来了新希望,靶向BCMA的CAR-T疗法、ADC疗法和双特异性抗体疗法成为了治疗这一疾病的破局点。
BCMA CAR-T疗法最受关注,国内药企临床数据优异
CAR-T疗法因其显著的治疗效果一直受到业内追捧,而BCMA作为治疗多发性骨髓瘤的理想靶点,把对BCMA CAR-T疗法的关注度推向了更高。
2021年3月,BMS与Bluebird Bio联合开发的、以BCMA为靶点的CAR-T细胞产品Abecma获得美国FDA批准上市,用于治疗复发或耐药多发性骨髓瘤,成为了全球第五款上市的CAR-T产品,同时也成为了首款针对BCMA靶点的CAR-T产品。
虽然Abecma的上市历程略显波折,但这一结果令聚焦BCMA赛道新疗法的药企备受鼓舞,同时也加剧了该赛道的竞争势头。
目前,这一疗法在国内外企业中均有布局,在国内,进行BCMA CAR-T疗法研发的药企进展都较为顺畅,除传奇生物获批外,科济药业、信达生物/驯鹿医疗、亘喜生物、恒润达生等企业的临床研究进展靠前。
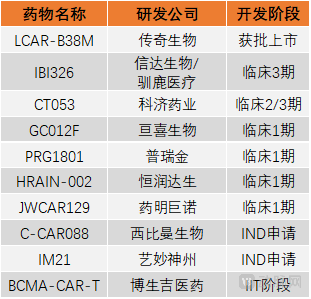
国内部分BCMA CAR-T疗法研发企业
cilta-cel是传奇生物与杨森合作开发的靶向BCMA的CAR-T抗癌药物,此前曾凭借治疗复发/难治性多发性骨髓瘤达到100%客观缓解率的临床数据而惊艳业内。这是一种结构差异化的CAR-T细胞疗法,包含一个4-1BB共刺激结构域和两个旨在提高亲和性的BCMA靶向单域抗体。
2021年12月,传奇生物发布了关于cilta-cel的最新数据,其对97例复发/难治性多发性骨髓瘤患者进行的1b/2期CARTITUDE-1研究结果显示,患者总缓解率(ORR)高达98%,在21.7个月的随访后,完全缓解率(sCR)达到83%。同时,2年无进展生存率(PFS)为61%,2年总生存率(OS)为74%。
临床试验中表现出的高有效率,也成为了传奇生物此次获批的基石。
紧随传奇生物cilta-cel之后的,便是信达生物与驯鹿医疗共同合作开发的IBI326,该药目前处于临床2/3期研究阶段。根据2021年ASH年会上展示的最新1/2期注册性临床研究结果,其试验共纳入79例受试者,在受试患者中,IBI326的ORR为94.9%,完全缓解/严格意义的完全缓解(CR/sCR)为58.2%,且随着随访时间的延长,反应有加深趋势。回输后6个月、9个月和12个月的PFS分别为78.0%、76.0%和71.0%,整体数据展现了IBI326卓越持久的有效性和优异的安全性。
科济药业BCMA CAR-T疗法的候选产品CT053同样进展较快,并因其优秀的临床数据获得了FDA孤儿药资格和NMPA的突破性治疗药物品种资格。在2021年ASH年会上,科济药业公布了CT053的最新研究进展,其数据来自于一项在中国开展的多中心的、开放标签的Ⅰ/Ⅱ期临床试验——LUMMICAR-1研究,共纳入14名受试者。
数据显示,CT053的ORR为100%(14/14),其中78.6%(11/14)的患者达到严格意义的完全缓解(sCR),并且有9例患者持续完全缓解及以上(CR/sCR)超过12个月,92.9%(13/14)的患者达到非常好的部分缓解(VGPR)。12个月的无进展生存率为85.7%(12/14)。
除以上企业外,国内药企正在对BCMA CAR-T疗法进行着新一轮的创新,比如,亘喜生物正致力于研发靶向BCMA/CD19的双靶点CAR-T疗法,西比曼生物则从CAR-T药物制备工艺方面进行着创新,其候选药物C-CAR088在中国的IND申请已于今年获批。
已有产品获批上市,海外药企加剧BCMA CAR-T竞争态势
在国外,除了已经上市的Abecma外,Eureka、Poseida、Allogene等企业的BCMA CAR-T疗法值得关注,但目前来看,这些企业的候选产品大都处于初期临床阶段,需要更加详实的数据对疗法效力进行支撑。
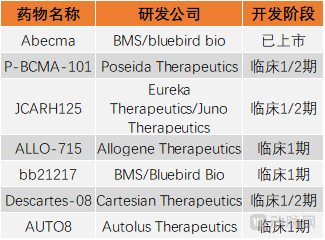
国外部分BCMA CAR-T疗法研发企业
由Poseida Therapeutics设计开发的,是靶向BCMA的同种异体CAR-T候选产品——P-BCMA-101,根据2021年ASH年会上Poseida最新公开的1/2期PRIME临床试验中期结果,共有98名患者接受了P-BCMA-101的给药,该药展现出了较强的抗肿瘤活性,且在所有患者中耐受性良好。同时,Poseida提出,P-BCMA-101与利妥昔单抗联合使用是目前观察到的最佳治疗方案,该疗法纳入了14名患者,其ORR为78%,部分缓解或完全缓解率(VGPR/sCR)为43%,在数据截止时的总生存率(OS)为100%。
而Eureka Therapeutics则是与Celgene旗下子公司Juno Therapeutics达成合作,共同开发靶向BCMA的CAR-T新药——JCARH125。目前,该药已进入1/2期临床试验阶段,但其最新数据仍然停留在2018年的第60届ASH年会上,试验共入组44名至少接受过三次治疗的多发性骨髓瘤患者,其ORR为82%,在最低剂量组,ORR为79%,完全缓解率(CR)为43%。
Allogene在众多开发BCMA CAR-T疗法的公司中独树一帜,主攻同种异体CAR-T,其候选产品ALLO-715正处于1期临床阶段。众所周知,2021年10月,Allogene因旗下候选药物的临床试验导致患者染色体异常而被FDA叫停了全部CAR-T疗法试验,直至今年1月,其暂停才被全部解除。ALLO-715的临床数据因此备受关注。根据2021年ASH年会上公布的最新数据,截止2021年10月14日,共48名患者入组,其ORR为71%,46%的患者取得了非常好的部分缓解(VGPR),CR/sCR在25%。
除以上公司外,还有Cartesian、Autolus等公司也在致力于新发多发性骨髓瘤CAR-T疗法的研发。
BCMA赛道百花齐放,ADC与双抗疗法正迎头赶上
目前,靶向BCMA的创新疗法并不局限于CAR-T领域,ADC疗法与双特异性抗体疗法也正在这一赛道持续地发光发热。
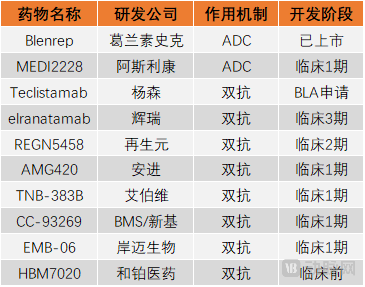
国内外靶向BCMA的ADC与双抗药物研发企业(部分)
靶向BCMA的ADC药物以葛兰素史克(GSK)最有代表性,其产品Blenrep已于2020年8月获批,成为全球首款被批准的抗BCMA疗法。
Blenrep的获批,是基于关键性DREAMM-2研究的临床数据,该项研究共入组了196例既往过度治疗的复发/难治性多发性骨髓瘤患者,入组患者被随机分为两组,接受每三周一次2.5mg/kg或3.4mg/kg剂量Blenrep治疗。
在2020 ASCO虚拟会议上,GSK公布了该研究的13个月随访数据。试验结果表明:在接受中位治疗的患者中(n=97),2.5mg/kg剂量组的总缓解率(ORR)为31%(n=30/97),3.4mg/kg剂量组的ORR为34%(n=34/99)。在2.5mg/kg剂量组中,58%(n=18)的患者病情取得了非常好的部分缓解,包括3例严格意义上的完全缓解的患者。
双特异性抗体疗法主要以BCMA和CD3为靶点,通过招募T细胞对BCMA高表达的骨髓瘤细胞进行杀伤。目前,尚未有靶向BCMA和CD3的双抗新药获批上市。
双抗疗法治疗复发/难治性多发性骨髓瘤的潜力曾经因为安进的AMG 420而大放异彩,2018年,安进公布了关于AMG-420的临床数据,接受最高剂量AMG-420治疗的5例患者全部获得了严格的完全缓解(sCR),这一数据展现了AMG-420的强劲疗效。但是,由于半衰期较短,目前针对该药的临床试验已经暂停。针对半衰期较短的问题,安进还推出了另一款靶向BCMA和CD3的候选产品AMG701,不过,CRS风险对这款产品的临床试验造成了阻碍,安进同样选择最终中止了该临床试验。
除安进外,杨森、辉瑞、艾伯维、再生元等药企均布局了BCMA/CD3双抗疗法,并且都有较为理想的进展。
杨森的Teclistamab进展最为迅速,已经于2021年底向美国FDA递交了关于该产品的BLA申请,有望成为全球首款获批的BCMA/CD3双抗新药。根据2021年ASH年会上杨森公布的更新数据,中位随访近8个月,患者ORR为62%(93/150),58%达到非常好的部分缓解(VGPR),29%达到CR。
紧追其后的是辉瑞的elranatamab(PF-06863135),该药现已进入3期临床研究阶段,根据此前公布的临床1期数据,在共入组的30例患者中,接受每周215~1000 μg/kg有效剂量的20例患者总缓解率(ORR)为80%,其中6例患者达到严格意义上的完全缓解,3例患者达到很好的部分缓解,另6例患者达到部分缓解。最高剂量组(1,000μg/kg)的ORR高达83%(5/6例)。
此外,艾伯维的TNB-383B在临床1期实验中,其ORR达到了52%;再生元候选产品REGN5458的1期临床数据则展示了所有剂量组中35.6%的ORR,其中,81.3%的患者达到了非常好的部分缓解。
除了国外药企,和铂医药、岸迈生物等国内创新药企业也已经在该赛道进行了布局,由此来看,BCMA/CD3双抗的竞争态势已进入白热化阶段。
从临床数据看BCMA产品的疗效与安全性
治疗多发性骨髓瘤,BCMA固然是一个理想靶点,众多药企挤占BCMA赛道,也充分肯定了这一靶点的治疗潜力,但是,从目前临床数据来看,BCMA赛道显然还存在着不置可否的局限性:
首先,根据目前所有疗法的临床数据,一些疗法虽然已经获批上市或在疗效上十分显著,但是在安全性方面仍令人担忧。比如,GSK的Blenrep就曾因眼部副作用陷入争议,在其关键性DREAMM-2研究中,Blenrep会造成71%的患者出现角膜病变/微囊样上皮改变,而在DREAMM-2中国地区临床数据中,也有近四分之三的患者出现了角膜病变。由于眼睛相关的副作用在此前的药物中很少见,这一副作用引起了医生与研究者的担忧。
类似的眼部副作用,也出现在了阿斯利康靶向BCMA的ADC候选产品MEDI2228上。在其临床1期试验的不良反应中,58.5%的患者出现了畏光,其中17.1%的患者不良反应为3级或4级。因其试验的主要终点为评估安全性与耐受性,阿斯利康引用“安全性/有效性”作为停药原因,如今已将MEDI2228从产品管线中删除,不再推进临床试验。
此外,细胞因子释放综合征(CRS)作为CAR-T与双抗药物中较为严重的不良反应事件,目前发生率较高。比如,传奇生物的cilta-cel虽然疗效惊人,但是在其一项1b期研究中,93%的患者出现了CRS,最为严重的一名患者因CRS而死亡。就算是BMS与bluebird bio联合研发且已经上市的BCMA CAR-T药物Abecma,也不能忽视CRS。根据其随访超过2年的最新数据,在128例Abecma治疗的患者中,CRS发生率高达84%,虽然大多为1/2级,但是仍然有5例患者出现3级CRS,1例患者出现4级CRS,1例患者出现5级CRS。
此外,安进的双抗疗法曾经因疗效显著而备受关注,AMG420因药物半衰期短而终止研发,但是延长其半衰期的AMG701目前也处于暂停状态,据了解,AMG701在首个临床数据中披露,其CRS发生率在65%,其中9%的患者为3级CRS,虽然ORR已高达83%,但是由于需要优化FDA的安全监测和缓解措施,AMG701的进展已陷入停滞。
虽然对于复发/难治性多发性骨髓瘤患者而言,在尚无有效治疗方案的前提下,可以接受一定的安全性风险。但未来在进一步的产品研发过程中,安全性问题仍将会是产业关注的重点之一。
第二,除了安全性外,BCMA的疗效目前并不稳定,一些候选产品在临床试验中展现的治疗效力并不理想。目前,最为见效的治疗手段还是BCMA CAR-T疗法,在国内,临床试验领先的企业其疗法的ORR均能保持在90%-100%之间,完全缓解率能维持在60%左右,最高可达83%。信达生物/驯鹿医疗与科济药业12个月的PFS能够保持在70%以上,而传奇生物更详细的数据表明,其候选药品2年的PFS已经达到了61%,2年的总生存率也高达74%。
有了国内数据的比较,海外药企的产品疗效却无法达到如此之高,其ORR基本在70%-80%之间,完全缓解率普遍在45%以下。就连已经上市的Abecma,其实数据也并不完。最新数据显示,中位随访24.8个月,其ORR维持在73%,仅有33%达到了完全缓解,好在PFS数据优异,18个月的PFS在65%,24个月的PFS在51%。
而在ADC疗法和双抗疗法中,除了辉瑞双抗疗法elranatamab的ORR达到80%外,其他疗法的ORR仅在50%或60%左右,Blenrep的ORR甚至只有31%,与 DREAMM-1临床研究中其ORR达到60%的数据相差甚远。
那么,这些疗效较为一般的候选产品,在安全性上怎么样呢?目前来看,这些药物的安全性似乎略有提高,以Allogene的产品为例,ALLO-715的CRS发生率在53%,均为1/2级;辉瑞双抗疗法elranatamab的CRS发生率虽高达73%,但是均小于2级;杨森Teclistamab与elranatamab类似,虽然CRS发生率在70%,但是均为1/2级,不过中性粒细胞减少症较为严重,发生率在65%,3级、4级则在40%。
由此可见,想要在BCMA赛道脱颖而出,众多药企不仅需要在疗效上下功夫,还需要确保更高的安全性,比如,革新药物的设计方式、开发除CAR-T、ADC、双抗之外的新疗法、改善药品制备工艺、挖掘BCMA在其他疾病领域的治疗潜力等。此外,目前很多候选产品还处于临床早期阶段,后续的治疗效力仍需期待。
有数据显示,多发性骨髓瘤药物在2017年的销售额接近140亿美元,预计到2027年将达到近290亿美元。BCMA药物拥有着不断增长的市场空间。在未来,期待有更多BCMA新药上市,为众多多发性骨髓瘤患者带来治疗希望,也期待BCMA靶点能够在其他疾病领域继续发挥潜力。






























