从1993-2020年FDA批准的新药统计数据可以看出,新分子实体(即小分子药物)的研发经历过辉煌时期,从占比最高为96%逐步下降到2020年的75%左右。随着抗体、基因疗法、细胞疗法、ADC、溶瘤病毒等众多创新生物技术的出现,小分子研发数量有进一步缓慢下降的趋势。
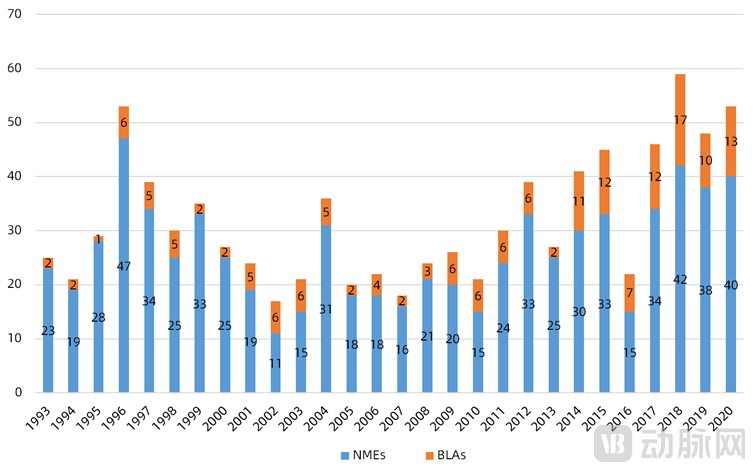
图1 FDA历年批准的新分子实体(new molecular entities, NMEs)和生物制剂许可(biologics license applications,BLAs)申请数量(来源:Asher Mullard.2020 FDA drug approvals.Nat Rev Drug Discov,2021 Feb;20(2):85-90.)
而在市场方面,对比近20年的创新药销售数据,2000年全球销售额前十的创新药中8个为小分子药物,从2008年开始销售额前十的创新药中小分子药物开始小于等于5个,到2019年前十中小分子仅有4个,在整体销售额中的占比也呈现逐步下降趋势,小分子药物的市场正在逐步被侵蚀。
除了抗体、基因疗法、细胞疗法等新型生物药的崛起强势占领了部分小分子药物市场,小分子药物研发也受限于新靶点发现与小分子库多样性的增速逐年降低从而使得小分子药物的开发处于相对较低的成功率。然而,近年来PROTAC技术、分子胶、AI药物研发等新技术的发展与进步给小分子药物研发带来了新的研发思路,小分子药物研发重新焕发了生机。
为了更直接地研究国内小分子药物研发的创新能力,我们梳理了截止2021年10月的科创板与港交所18A上市企业的小分子药物创新产品管线,以期对于国内小分子药物研发现状有个具体的了解。
通过对药物靶点、研发进展、创新技术等多维度的统计,我们得出了以下几点结论:
1.在大多数靶点上国内研发进展仍不及全球,但差距正在逐渐缩小;
2.创新药适应症集中于肿瘤领域,实体瘤、肺癌、血液肿瘤居前三;
3.创新靶点主要有36个,热门前三是KRAS、FGFR4、SHP2;
4.SHP2、FASN、IAP/XIAP、FXR、FGFR4靶点研发处于全球领先水平;
5.小分子领域出现诸多新的研发思路,可能在PROTAC技术、分子胶、变构调节等方面实现新的突破。
136个创新靶点,5个靶点全球领先
根据未有产品在全球上市或2021年批准上市的标准,统计各药企的产品管线,包括自主研发及权益引进,我们共统计到科创板与港交所企业关注的创新靶点共有36个。其中最受关注的靶点是KRAS共9个产品处于临床研发中;排名第二的是FGFR4,有7个在研产品;随后则是SHP2和TYK2、THR-β、FASN,分别有4个和3个在研产品。
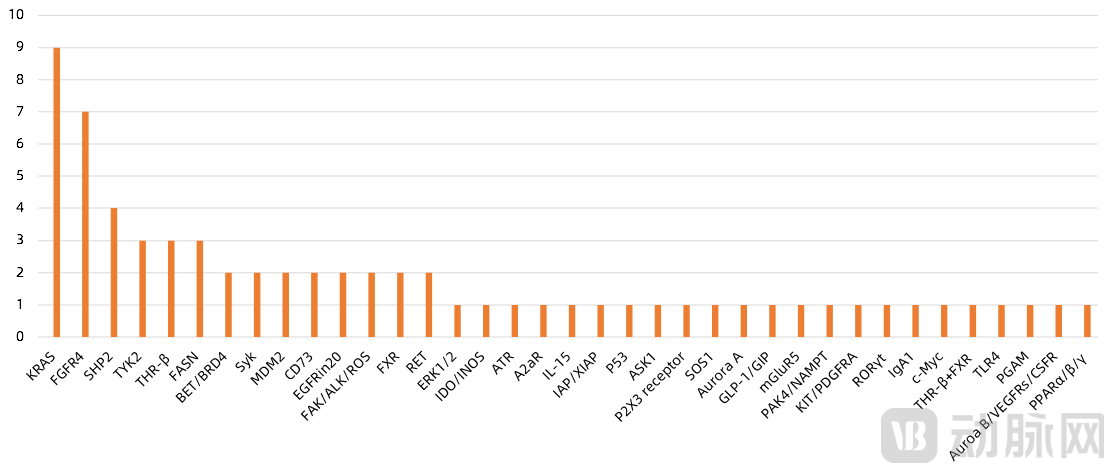
图2 小分子药物创新靶点
在上述的36个创新小分子靶点中,肿瘤是创新药企研发的重点领域,并且在治疗领域上呈现拓展的趋势,占比72.17%;代谢类疾病次之,占比12.17%;中枢神经系统类疾病紧跟其后,占比11.3%;其余疾病还涉及抗感染、免疫及其他疾病。在肿瘤领域中,实体瘤居首位,占比24.14%;其次是肺癌,占比19.54%;而血液肿瘤、结直肠癌、肝癌也是创新药企关注的肿瘤领域,分别占比12.64%、10.34%、10.34%;另外,各药企分别有各自聚焦的领域,包括上皮性肿瘤、胰腺癌、乳腺癌、脂肪瘤、卵巢癌、前列腺癌、甲状腺癌及其他肿瘤。

图3 创新靶点涉及的疾病领域
靶点层面加速创新,同全球的研发差距不断缩小。虽然大部分靶点药物国外的临床进展比本土药企快,但是仍然有部分靶点相比全球处于领先或同一水平。在研的创新靶点中,国内SHP2抑制剂的研发处于临床Ⅱ期,领先于国外的临床Ⅰ/Ⅱ期;而FASN(临床Ⅲ期)、IAP/XIAP(临床Ⅱ期)、FXR(临床Ⅱ期)、FGFR4(临床Ⅰ/Ⅱ期)这4个靶点与全球研发处于同一水平。
创新药企要想脱颖而出,差异化创新是关键。在热门的10个研发靶点中,KRAS抑制剂和SYK抑制剂国外已有产品上市,国内研发仍处于临床Ⅰ期阶段;国外TYK2抑制剂已有新药申请,而国内的TYK2抑制剂才处于临床前研究;另外THR-β、BET、MDM2-p53以及CD73这几个靶点落后全球1个临床阶段。因此,热门靶点中只有3个靶点的临床进展赶上全球进度,国内创新药企优势不大,只有差异化创新,以国内临床疾病为指导,本土创新药企才能拥有竞争优势。
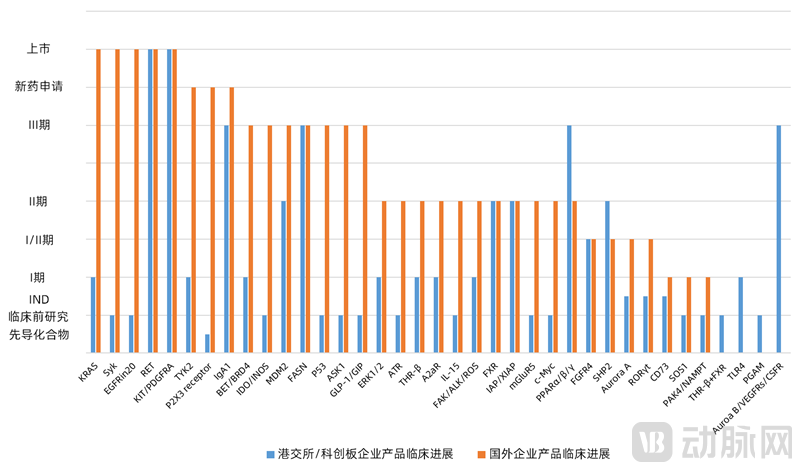
图4 同个靶点国内外临床进展对比(同个靶点选取临床进展最前的产品)
2热门靶点研究进展
RAS癌基因编码一种GTP结合蛋白,包含KRAS、NRAS和HRAS三种亚型,控制细胞的生长、增殖和分化。RAS是人类肿瘤中最常见的突变癌基因之一,而RAS基因驱动的癌症中有85%是由KRAS的突变引起的,存在于90%的胰腺癌、30-40%的结肠癌以及15-20%的肺癌中。在KRAS突变的肿瘤中,最常见的突变位点有KRAS G12D、KRAS G12V和KRAS G12C,其中KRAS G12C占比约40%。
目前化疗仍是治疗KRAS突变肿瘤患者的标准疗法,但是KRAS突变通常与反应不佳和对化疗的耐药性增强有关,因此对特异性抑制KRAS的药物有着迫切和重大的需求。然而,KRAS长期以来一直被认为是不可成药的靶点。首先,KRAS是一种小GTP酶,分子量小,几乎没有与药物结合的口袋。其次,KRAS与GDP和GTP结合的浓度达到皮摩尔级别,因此在浓度上药物难以与GTP/GDP竞争KRAS蛋白结合结构域,大大降低了开发核苷酸竞争性抑制剂的可能性。
2021年5月29日,美国FDA宣布加速批准安进公司(Amgen)开发的Lumakras(sotorasib,AMG510)上市,用于治疗携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者,成为首款靶向特定KRAS突变基因的抗癌疗法,表明KRAS靶点不可成药已成为历史,具有里程碑式的意义。
国内KRAS G12C小分子抑制剂的研发较国外进展较慢,目前进展最快的是加科思的JAB-21822,处于临床Ⅰ期,用于治疗携带KRAS G12C突变的非小细胞肺癌和结直肠癌患者(CRC)。另外,在科创板和港交所18A上市的企业中,布局KRAS G12C领域的还有和誉、德琪医药、诺诚健华、艾力斯、泽璟制药,以及微芯生物等。
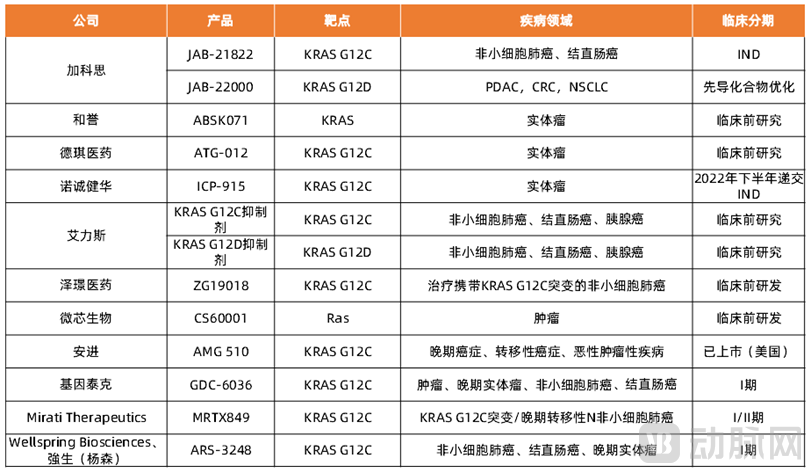
表1 KRAS抑制剂部分国内外药企
虽然国外已有治疗NSCLC的KRAS G12C抑制剂AMG510上市,但是对于KRAS G12C突变的CRC治疗效果不大。因此在CRC以及其余KRAS G12C突变的肿瘤领域上,国内外处于同一水平。此外,为避免肿瘤患者对于KRAS G12C抑制剂的单药疗法产生耐药性同时增加治疗效果,KRAS G12C领域已转向联用策略。例如,Amgen于2019年12月启动了AMG510联合SHP2抑制剂RMC-4630用于治疗携带KRAS G12C突变的晚期实体瘤的临床Ⅰ期试验。Mirati已于2020年4月启动了KRAS G12C抑制剂MRTX849联合SHP2抑制剂TNO155用于治疗晚期癌症、转移性癌症及恶性肿瘤的临床Ⅰ/Ⅱ期试验。
SHP2是一种由PTPN11基因编码的蛋白酪氨酸磷酸酶(PTP),长期以来被认为是一种原癌基因。作为重要的信号转导节点和调节因子,SHP2将受体酪氨酸激酶(PTK)内的信号通过RAS信号通路向下游转导,从而调控癌细胞的增殖。PTP和PTK的异常活性可导致异常的酪氨酸磷酸化并引发多种癌症。
SHP2在多种癌症类型中发挥重要作用,包括(I)组成性活跃RAS通路信号传导,如非小细胞肺癌、食管鳞状细胞癌、结直肠癌、胃癌、胰腺癌、卵巢癌中的KRAS G12C/D/V以及非小细胞肺癌、黑色素瘤、卵巢癌及膀胱癌中的第3类BRAF或NF1 LOF突变;(II)RTK变异及融合,如非小细胞肺癌、食管鳞状细胞癌、头颈部鳞状细胞癌中的EGFR突变及扩增、乳腺癌中的HER2扩增以及非小细胞肺癌中的ALK、RET或ROS1突变。
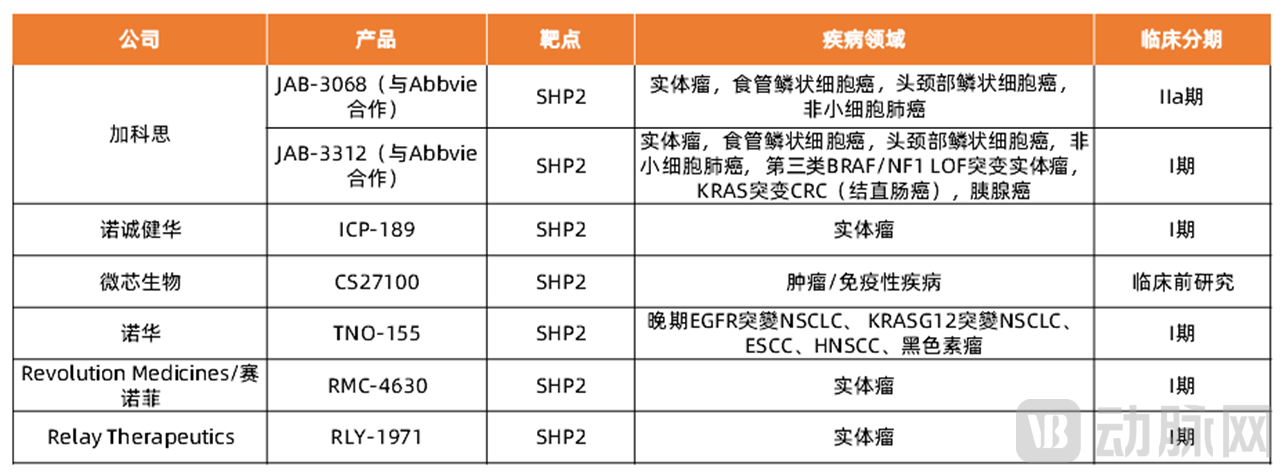
表2 SHP2抑制剂部分国内外药企
全球研发中,国内创新药企加科思的SHP2抑制剂JAB-3068临床进展最快,处于临床Ⅱa期,并且已经将SHP2抑制剂授权给Abbvie,与Abbvie共同开发SHP2抑制剂JAB-3068。另外国内药企诺诚健华和微芯生物等在SHP2抑制剂也有布局。而国外有Revolution Medicines/赛诺菲、Relay Therapeutics等药企布局SHP2靶点,用于治疗实体瘤,处于临床Ⅰ期试验。
由于SHP2是PD-(L)1通路的下游调节因子,并且通过RAS / RAF / MEK/ERK通路发挥作用,因此SHP2抑制剂与PD-1抑制剂、KRAS抑制剂及RTK抑制剂等联用可以增强单药疗法的治疗效果,克服单药疗法的耐药性。加科思已经启动SHP2抑制剂JAB-3068联合PD-1抗体治疗ESCC,HNSCC,NSCLC,目前处于临床Ⅰ期试验。并且开启SHP2抑制剂JAB-3312联合PD-1抗体、MEKi和KRAS G12Ci用于治疗食管鳞状细胞癌,头颈部鳞状细胞癌,非小细胞肺癌、KRAS突变结直肠癌、胰腺癌、KRAS G12C突变阳性非小细胞肺癌,结直肠癌。
成纤维细胞生长因子受体(FGFR)是高度保守及高表达的跨膜酪氨酸激酶受体。FGFR是高度相似受体家族,包括 FGFR 1-4。FGFR异常存在于约7.1%的实体瘤,其中最受FGFR异常影响的癌症是31.7%的泌尿上皮性膀胱癌、25.2%的胆管癌、20%的肝细胞癌、17.5%的乳癌及6.7%的胃癌。特定的FGFR异常存在于特定种类的癌症,FGFR4通路则在肝细胞癌的过度激活中常见。
FGFR 4特异性抑制剂相比于泛FGFR抑制剂来说更具特异性,有利于治疗FGFR4信号异常激活的肝细胞癌患者,但泛FGFR抑制剂具有一定程度的FGFR抑制活性,因此可能与FGFR4抑制剂竞争。截止2021年5月,全球有三种泛FGFR抑制剂获批,中国并无获批的泛抑制剂,而在全球市面上并无FGFR4抑制剂出售。目前FGFR抑制剂国内与全球研发水平处于同一水平,本土创新药企和誉医药用于治疗FGF19阳性HCC的ABSK011处于临床Ⅰb/Ⅱ期试验。另外,加科思、基石药业、诺诚健华、云顶新耀等国内药企也有布局FGFR4领域。
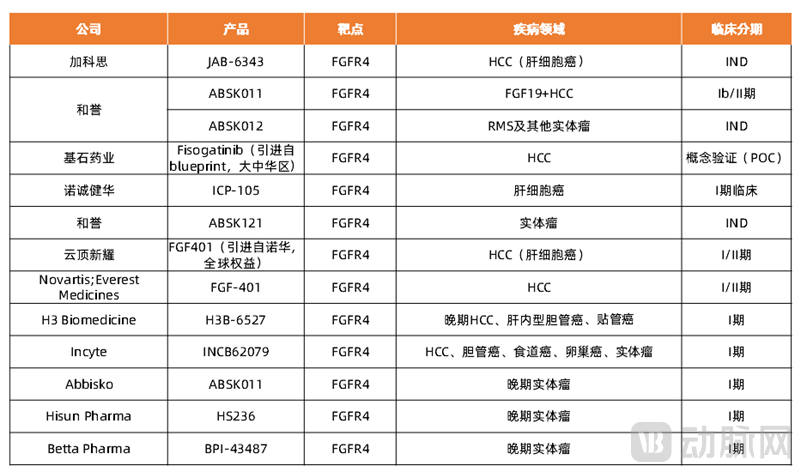
表3 FGFR4抑制剂部分国内外药企
3小分子药物研发创新技术
ADC、细胞疗法、基因治疗等新药物形式正在逐步兴起,而小分子药物作为最传统的药物形式,当前的发展受到生物药物的剧烈竞争,但也有其难以替代的优势。近几年,小分子领域出现了多种新技术推动小分子药物创新研发进一步发展。
相关企业:Arvinas、C4 Therapeutics、Kymera Therapeutics、基因泰克、辉瑞、阿斯利康、默沙东、安进、吉利德、勃林格殷格翰、葛兰素史克、新基、礼来、艾伯维、强生、嘉兴优博、上海睿因、成都分迪科技、和径医药、海创药业、加科思、科伦药业、石药集团、恒瑞医药、百济神州、丽珠集团、开拓药业、领泰生物、杭州多域生物、美志生物、恩瑞医药、凌科药业、五元生物、海思科、同源康、药明生物、美迪西等。
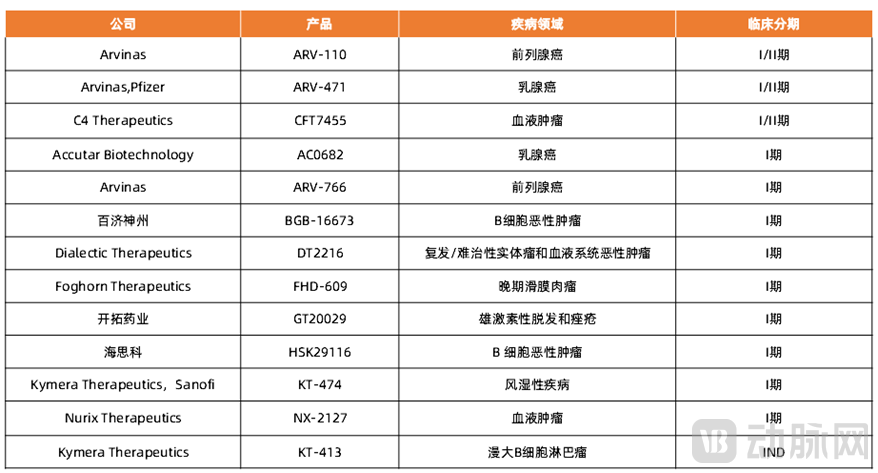
表4 部分进展较快的PROTAC企业及产品
PROTAC(Proteolysis Targeting Chimera,蛋白降解靶向嵌合体)是一种双功能小分子,是由靶蛋白配体和E3泛素连接酶配体通过Linker连接构成的,利用泛素-蛋白酶系统识别、结合并降解疾病相关的靶蛋白。PROTAC技术最大的优势之一是使靶点从“不可成药性”变成“可成药性”,在肿瘤、自身免疫性疾病领域已经取得了进展,同时在克服耐药性方面表现出巨大的潜力。
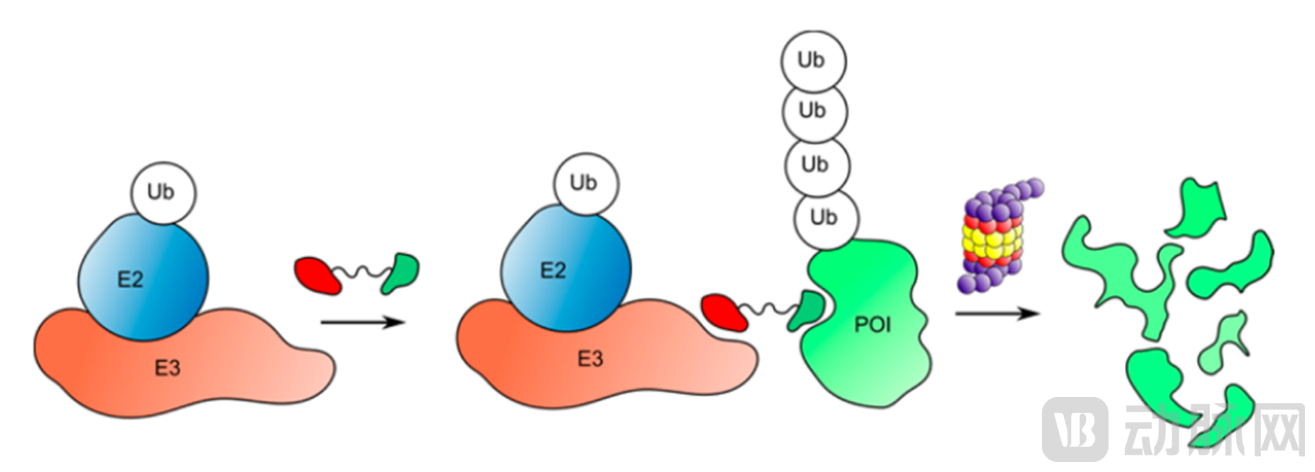
图5 PROTAC介导的泛素化和蛋白酶体的降解(Ub:泛素,POI:靶蛋白;来源:G.Burslem and C. Crews.Small-Molecule Modulation of Protein Homeostasis.Chem Rev. 2017 Sep 13;117(17):11269-11301.)
相关企业:诺华、百时美施贵宝、C4 Therapeutics、勃林格殷格翰、Monte Rosa Therapeutics、万春医药、标新生物等。
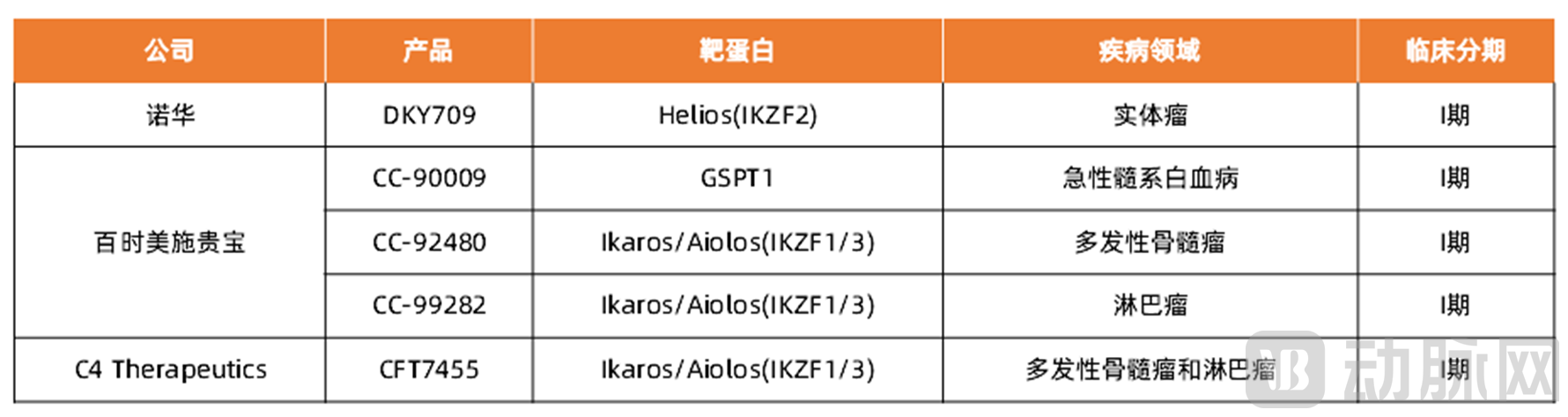
表5 部分分子胶企业及产品
分子胶(Molecular Glues)是一类诱导接近的小分子,可以通过形成三元复合物促进两种蛋白质的二聚化或共定位,可以对各种生物过程进行精确的时间控制,例如信号转导、转录、染色质调节以及蛋白质折叠、定位和降解等。当其中一个蛋白质分子为泛素连接酶时,分子胶可以引起另外一个蛋白质发生泛素修饰,并通过蛋白酶体途径发生降解。尽管分子胶水和PROTACs都是蛋白降解剂,但是作用机制和分子结构特征有所不同。通常来说分子胶分子量很小,理化性质便于优化。分子胶主要诱导或稳定泛素连接酶和底物蛋白之间的PPI进而导致蛋白降解,能够降解不可接近的靶蛋白,不需要在靶蛋白上有结合袋。
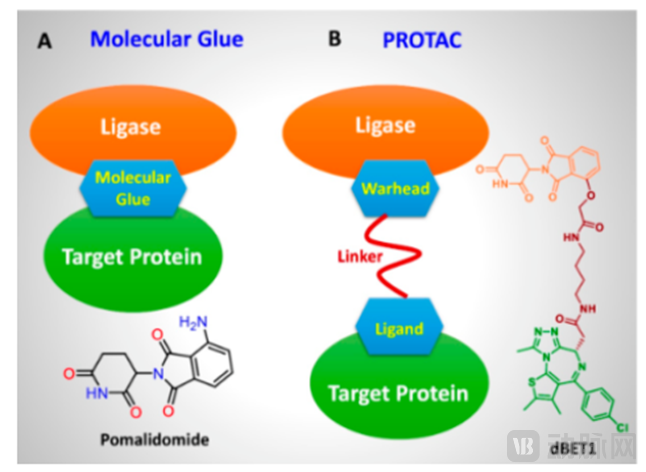
图6 分子胶和PROTAC的区别(来源:Dong et al.Novel regulation of Ras proteins by direct tyrosine phosphorylation and dephosphorylation.Cancer Metastasis Rev. 2020 Dec;39(4):1067-1073. )
沙利度胺类似物和芳基磺酰胺类抗癌药Indisulam等经典的分子胶降解剂都是利用E3泛素连接酶与靶蛋白之间的蛋白-蛋白相互作用界面,重编程泛素连接酶的选择性,以催化剂的方式驱动靶点泛素化。因此,分子胶解决了传统小分子抑制剂的局限性,使得一部分靶点从“无成药性”变为“可成药性”。由于分子胶相比PROTAC有更小的分子量以及更好的成药性,有较好的研究前景,然而设计难度大,因此目前还没有很好的药物开发策略。
DNA编码化合物库(DEL)
相关企业:HitGen、X-Chem、GSK、Novartis、Nuevolution(被Amgen收购)、Vipergen、HitGet、Haystack Sciences、DyNAbind GmbH、Plexium、HotSpot、药明康德、成都先导、皓元医药等。
DNA 编码化合物库(DEL)指通过组合大量化学分子砌块来合成巨型规模的化合物库。每个分子砌块都对应了一个独特的DNA代码。因此,由多个分子砌块合成的化合物也具有一个独特的DNA代码,此代码由化合物中所有分子砌块的代码组合生成。据此原理DEL技术可将小分子化合物库增至亿万级别,极大增加成药化合物的几率。DEL技术正是近年新兴的小分子药物筛选技术之一,凭借其库容量大、筛选速度快的特点,已成为化合物筛选的主流方法之一。DNA编码化合物库的构建策略主要有DNA记录合成法、DNA模板法,除此之外还有DNA routing合成法、ESAC合成法等。目前GSK的GSK-2982772(ATP竞争型的RIP1酶抑制剂,用于银屑病、类风湿关节炎和溃疡性结肠炎的治疗)、GSK-2256294(可溶性环氧化物水解酶抑制剂,用于糖尿病、迟发性脑出血等)和GSK-3145095(RIP1酶抑制剂,用于治疗胰腺癌)均已处于临床试验中。
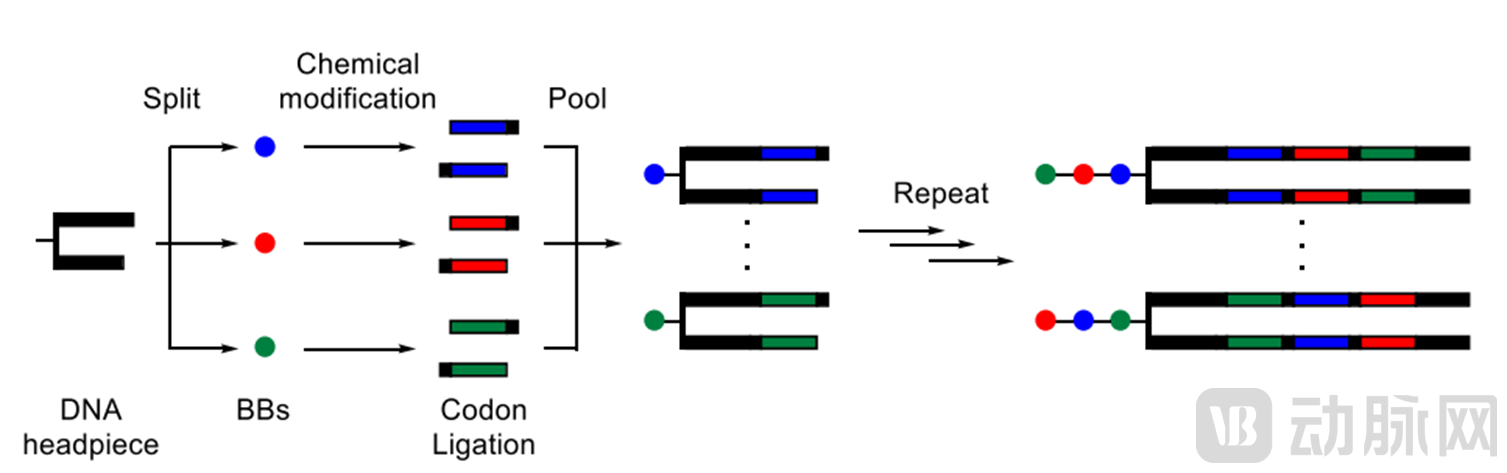
图7 DNA编码化合物库合成图示(来源:Vipergen ApS, Copenhagen, Denmark.An overview of DNA-encoded libraries: A versatile tool for drug discovery.Prog Med Chem. 2020;59:181-249.)
相关企业:Atomwise、IBM Watson、Insitro Medicine、BenevoientAI、ProteinQure、Berg Health、Insilico Medicine、晶泰科技、Panorama Medicine、DeepBiome、Enginebio、未知君、英飞智药、智药科技、深度智耀、AccutarBio、费米子、燧坤智能、星亢原、星药科技、剂泰科技、宇道生物、哲源科技、百图生科、冰洲石生物、亿药科技、望石智慧、索智生物、德睿智药、元启制药、云势软件、希格生科、知图生物、焕一生物、开心生活科技、科辉智药、分迪药业等。
人工智能(AI)在新药研发领域中发挥着至关重要的作用。随着自然语言处理、机器学习、深度学习、知识图谱等关键人工智能技术的发展,AI在靶点发现、苗头化合物与先导化合物发现、药物分子合成路线设计、疾病模型建立、新适应症挖掘等诸多方面赋能新药研发,极大提高了新药的研发效率。
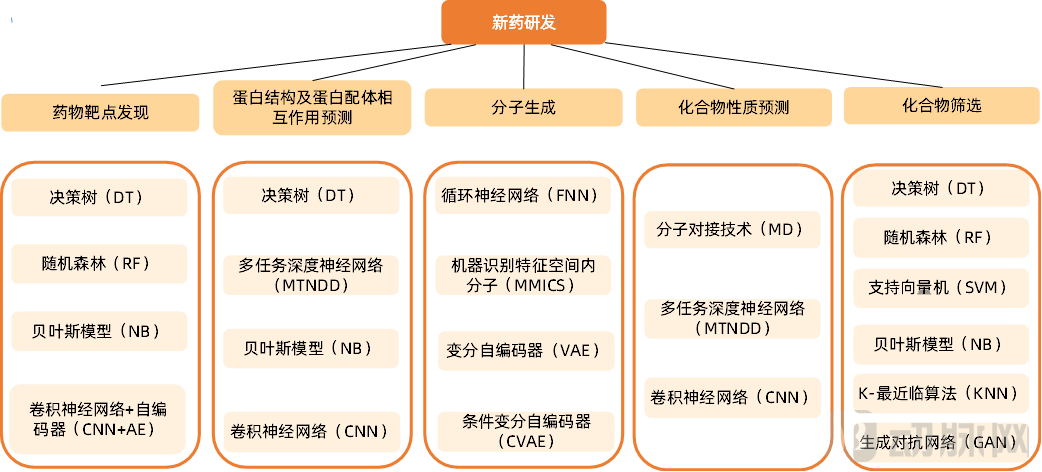
图8 新药发现各环节常用的人工智能技术
制药企业为进行新药研发,与基于AI技术的药物研发公司达成深度战略合作,利用人工智能技术平台加快新药研发效率。Atomwise专注于AI药物设计,其拥有的AtomNet® 是第一虚拟药物发现平台,与多家制药公司开展约1000个项目。
而国内的AI药物研发公司晶泰科技以数字化、智能化驱动药物创新,基于前沿的计算物理、量子化学、人工智能与云计算技术,提高分子生成、虚拟筛选、高精度活性预测等药物研发关键环节的效率与成功率、降低研发成本。
相关企业:诺华、罗氏、吉利德、百时美施贵宝、赛诺菲、Nimbus Therapeutics、HotSpot Therapeutics、Relay Therapeutics、Gain Therapeutics、Black Diamond Therapeutics、Revolution Medicines、宇道生物等。
变构调节(Allosteric Regulation)通过特异性影响蛋白构象变化,从而将其稳定在某个非活化或活化状态,这与传统的底物竞争性抑制剂有所不同。根据变构调节效果的不同,可将变构调节机制划分为变构抑制(Allosteric Inhibition)和变构激活(Allosteric Activation)两类。变构调节具有更好的选择性、安全性和克服耐药的潜力,使得一部分靶点从“无成药性”变为“可成药性”,引起了科学界和工业界的重点关注。随着结构生物学的发展,变构位点的确认变得相对容易,进一步推动了变构调节小分子药物的开发。

图9 变构调节机制示意图(来源:Mary Ann Clark,Matthew Douglas,Jung Choi. Metabolism of Biology 2e.OpenStax.2018)
除了上述阐述的小分子研发创新技术,还有基因编辑技术在新药研发中有着重要的作用。基因编辑技术的核心是通过程序化的人工核酸酶,定点对基因组DNA进行改造。对于小分子药物研发,基因编辑可以通过基因敲入、基因敲除、碱基转换、染色重排等解决临床前评价体系、新靶点发现、耐药性问题。