2012年,美国女孩艾米丽成为全球首例接受CAR-T细胞免疫疗法的儿童白血病患者,艾米丽幸运地治愈了白血病并至今未复发。CAR-T细胞治疗展现出的血液瘤治疗效果全世界有目共睹。但其实早在1989年,嵌合型抗原受体修饰T细胞(CAR-T细胞)概念就被提出。目前国内国外均有上市的CAR-T细胞治疗产品,临床研究项目超千个。
同样是2012年,法国科学家Emmanuelle Charpentier和美国科学家Jennifer Doudna开发的CRISPR/Cas9基因编辑技术被公开发表。相比于之前的技术,CRISPR/Cas9技术具有成本低、易上手、效率高等优势。2020年10月,她们也因此被授予诺贝尔化学奖,以表彰她们在基因组编辑方法研究领域做出的贡献。
也是2012年,为表彰英国科学家约翰·格登和日本医学教授山中伸弥,在“体细胞重编程技术”领域做出的贡献,他们被授予了诺贝尔生理学或医学奖。此前,日本科学家山中伸弥及其团队成功把4个关键基因(OCT3/4、SOX2、KLF4和c-Myc)通过逆转录病毒载体转入小鼠的成纤维细胞,使其变成多功能干细胞,开创了多潜能干细胞(iPSC)的研究先河。
命运让CAR细胞治疗、CRISPR基因编辑、iPSC这三个魔法般的技术领域在同一年获得了重大的突破和认可。这三个技术中任何一个就有机会衍生出强大的治疗功能和市场前景。那如果把它们组合在一起又会产生什么不一样的火花呢?让我们来看看这家名为“命运”的公司Fate Therapeutics(以下简称Fate)是如何大胆尝试的。
Fate,一家致力于发展iPSC细胞免疫治疗的临床时期生物制药公司,2007年成立于美国特拉华州,2013年于美国纳斯达克上市(NASDAQ:FATE)。距今,Fate已成立14个年头,上市近8年。在其上市的前七年中股价表现一直不温不火,2020年3月还曾陷入股价不足20美元的低谷期。可随后的不到一年时间中,Fate的股价持续上长,2021年1月14日Fate迎来了其股价的最高峰121.16美元,巅峰时期市值超过100亿美元。如今虽然略有回落,但股价也由发行时的6美元涨到如今的91美元,较上市时翻了15倍。是什么让Fate在不到一年的时间内股价翻了6倍,突然成了资本的宠儿?
首先,从团队来看,Fate拥有经验丰富的运营管理团队和科学研发团队。
Fate总裁兼CEO Scott Wolchko,负责Fate的财务、行政和运营。Wolchko拥有弗吉尼亚大学生化工程学士学位和佛蒙特大学生物医学工程学士学位。他曾担任过摩根士丹利(NYSE:MS)的银行投资家、Drugstore(NASDAQ:DSCM)企业发展高级总监、Bocada的首席财务官,在投资和管理领域拥有超过27年的工作经验。
首席技术官Mark Plavsic,负责监督Fate的细胞治疗制造、供应链和技术运营。在学术专业方面,Plavsic是南斯拉夫的贝尔格莱德大学病毒学和分子细胞生物学博士、病毒学和免疫学硕士、兽医博士,他还拥有美国兽医微生物学学院微生物学亚专业病毒学的董事会认证。
在工作方面,Plavsic曾担任Lysogene的首席技术官、Torque的CMC副总裁、Genzyme/Sanofi的产品生物安全主管等。Plavsic的技术专长涵盖药物开发和制造,包括关键动物原产地原材料、细胞培养介质、GMP QC测试、GLP分析开发、GMP生产、合同制造和供应链,Plavsic在大规模商业生物制剂的工艺开发和端到端产品开发方面拥有20多年的经验。
除此之外,团队成员还包括Receptos联合创始人、SVB Leerink战略顾问、Illumina Ventures顾问William Rastetter博士;Flagship Pioneering执行合伙人、Moderna产品战略总裁、Editas董事John Mendlein博士等。Fate的投资团队也可谓是众星云集,包括Venrock、Polaris Partners、ARCH、OVP Venture Partners、Astellas Venture Management等多家知名投资机构。
在专业团队的带领下,Fate致力于从公司专有的iPSC产品平台生成人类诱导多能干细胞(iPSC)来创建具有生物特性的基因工程克隆iPSC产品。iPSC具有在特定培养条件下无限增殖和多项分化的潜能,Fate使用iPSC建立细胞源,用于创建细胞治疗候选产品,相比于自体细胞治疗产品成分更明确均一、可实现大规模生产等特点。
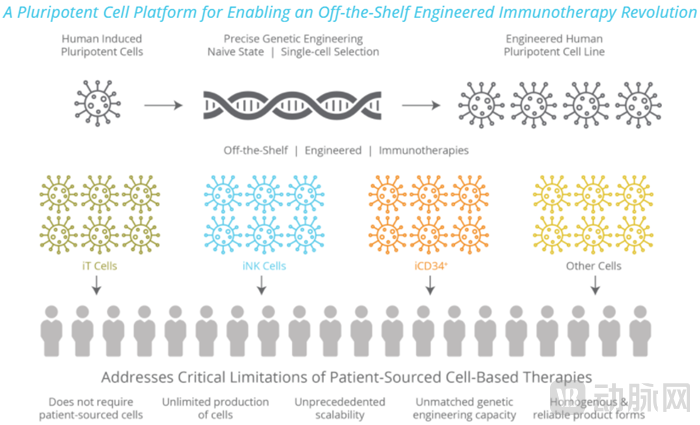
iPSC平台,图源Fate官网
Fate的iPSC平台在专利保护范围内可以进行基因工程、单细胞分离并选择iPSC 进行克隆扩张,该平台由300多项已颁发专利和150项待审专利申请组成的知识产权组合提供支持。
Fate的iPSC衍生细胞免疫治疗产品的制造由三个阶段组成。第一阶段是使用符合要求的健康人体供体细胞经过基因工程等处理方式诱导供体细胞的多能性,经过克隆建立主iPSC库;然后将细胞库中的细胞经过诱导分化形成特定的细胞(如CD34+细胞),再通过细胞培养等扩大和分化产生特定的细胞产品群;最后是通过符合要求的工艺处理细胞产品群,冷冻保存细胞产品。
为了开展iPSC平台的GMP生产、加工、规模开发和技术转让活动,加大后续iPSC衍生细胞免疫治疗产品的制造规模以及开展产品线的临床研究和IND活动,Fate在2019年9月开设了符合cGMP标准的制造场地,用于生产临床使用的iPSC衍生细胞治疗候选产品。2020 年1月,Fate又签订了一项占地20万平方英尺的租赁协议,以建立cGMP相关设施,其中包括一个4万平方英尺的cGMP细胞生产设施。该cGMP设施位于加利福尼亚州圣地亚哥,专为使用主iPSC库制造特定的细胞候选产品而设计。该设施已投入使用并获得了加利福尼亚州卫生局、食品和药物处的许可,可以用于细胞治疗产品的生产。
通过以上平台和生产过程,Fate目前在研产品包括13条候选产品线以及一条同种异体来源的非基因编辑的管线ProTmun(临床Ⅱ期阶段),候选产品管线的适应症包括实体瘤、血液瘤、淋巴瘤、多发性骨髓瘤等,其中FT500、FT516发展较快,FT819最近有新进展。

产品线,图源Fate官网
1.FT500,美国首个获准进行临床研究的iPSC衍生细胞疗法
FT500是一种iPSC衍生的NK细胞免疫疗法,它也是美国首个获准进行临床研究的iPSC衍生细胞疗法,用于治疗晚期实体肿瘤,目前处于临床I期研究阶段。
2020年11月,在癌症免疫治疗协会(SITC)年会上,Fate报告了截至2020年10月13日的第I阶段临床试验剂量升级阶段的临床数据。15名经过重症预治疗的患者,其中10人对前序治疗不敏感,使用了多达6剂FT500。报告中FT500没有显示出剂量限制毒性(DLTs),也没有患者报告FT500相关的严重不良反应事件(SAEs)或≥3级不良事件(AEs),也没有任何级别的细胞因子释放综合征(CRS)、免疫效应器细胞相关神经毒性综合征(ICANS)或GvHD事件报告。
2.FT516,全球首次为患者提供iPSC衍生细胞疗法
FT516是一种iPSC衍生的通用型NK细胞免疫疗法,旨在表达一种新型CD16 Fc受体,它是全球首次为患者提供iPSC衍生细胞疗法。该CD16 Fc受体融合了两个独特的功能:可增强 FT516的抗肿瘤活性、以促进高结合力和高亲和力。
FT516正在进行第I阶段临床试验研究。试验包括两种治疗方案:FT516作为复发/难治急性骨髓性白血病(AML)患者的单一疗法;FT516结合CD20靶向单克隆抗体治疗晚期B细胞淋巴瘤(BCL)患者。截至2020年5月18日,AML的第一阶段临床数据显示患者没有DLTs,没有FT516相关的SAE,也没有报告任何等级的CRS、ICANS或GvHD事件。截至2020年11月16日,BCL的第一阶段临床数据显示调查人员没有DLT,没有FT516相关的SAE,也没有报告任何等级的CRS、ICANS或GvHD事件。
3.FT819,首次iPSC衍生CAR-T细胞疗法中首位患者获得治疗
近日,Fate宣布,首个iPSC衍生CAR-T细胞疗法FT819的里程碑式I期临床试验中,首位患者已经开始接受治疗。FT819是一种针对CD19+恶性肿瘤的CAR-T细胞疗法,是首个来自克隆主iPSC细胞系的CAR-T细胞疗法。FT819在体外对表达CD19的白血病和淋巴瘤细胞系表现出与原代CAR-T细胞相当的抗原特异性的溶细胞活性。FT819在I期临床试验中可用于治疗复发/难治性B细胞恶性肿瘤,包括B细胞淋巴瘤、慢性淋巴细胞白血病和急性淋巴母细胞白血病。
4. ProTmune,FDA、欧盟授予该异基因细胞免疫治疗孤儿药称号
候选产品ProTmune作为一种实验性程序化细胞免疫疗法,用于预防细胞治疗的并发症,包括移植物抗宿主病(GvHD)。GvHD是接受异基因造血干细胞移植患者发病和死亡的主要原因,目前FDA尚未批准预防GvHD的疗法。2016年6月,FDA已经授予ProTmune快速通道资格,,用于降低异体造血干细胞移植患者急性GvHD的发生率和严重程度。2016年9月,FDA和欧盟委员会还分别授予了ProTmune的孤儿药产品称号,以加速ProTmune的开发和商业化进程。
包含上述部分产品,Fate目前共有七个产品已进入临床I期阶段。除此之外,Fate还积极与其他公司开展合作加速产品线的研发。
一方面,Fate通过与相关研究人员和顶级医疗中心建立合作,以加速开发并迅速将iPSC衍生的细胞治疗候选产品转化到人类第一临床试验。其中Fate的FT500和FT516项目与明尼苏达大学的NK细胞生物学家和临床研究员杰弗里·米勒博士团队进行合作。FT500是有史以来第一个向美国患者施用的iPSC衍生细胞疗法,而FT516则是全球首个为患者提供iPSC衍生细胞疗法。
Fate还与著名的T细胞生物学家、CAR-T细胞疗法的先驱米歇尔·萨德兰博士领导的纪念斯隆·凯特林癌症中心建立了合作关系,以支持iPSC衍生的CAR-T细胞治疗候选产品(包括FT819)的发展。此外,Fate还与奥斯陆大学医院合作,由NK细胞生物学和细胞免疫球蛋白样受体的领先专家卡尔-约翰·马尔姆伯格博士领导,该合作将有助于促进持久性和增强抗肿瘤效力的NK细胞修饰,并研发新的iPSC衍生NK细胞产品候选产品供开发。
另一方面,Fate通过有选择的与行业领先的战略合作伙伴共享专有的iPSC产品平台,以开发iPSC衍生的细胞疗法。2018年9月,Fate与小野制药有限公司(Ono)签订了合作和期权协议,共同开发和商业化两个现成的iPSC衍生CAR-T细胞治疗候选产品。第一个候选产品是iPSC衍生针对某些淋巴细胞白血病的CAR-T细胞治疗,第二个候选产品是iPSC衍生的治疗某些实体肿瘤CAR-T细胞治疗。
根据协议条款,小野就签订协议向Fate支付了1000万美元的预付款。2020年12月,Fate与小野签订了一份信件协议,根据该协议,小野提名并交付给Fate专有的抗原结合领域,针对某些实体肿瘤上表达的抗原以开发第二个合作候选产品。此外,Fate也将有资格获得高达8.85亿美元的里程碑付款。
2020年4月,Fate与强生旗下的杨森(Janssen)制药公司签订了合作和期权协议,开发和商业化iPSC衍生的CAR-NK细胞和CAR-T细胞治疗候选产品,用于治疗某些血液恶性肿瘤和实体肿瘤。根据协议条款,截至协议生效之日,Fate收到了1亿美元,其中5000万美元是预付、不可退还和不可贷记的现金付款,5000万美元由强生创新-JJDC公司以股权投资的形式支付。此外,Fate还将有资格获得高达30亿美元的潜在里程碑付款,以及就本次合作开发的药物在未来的销售额分成。
此外,Fate还通过与审批部门申请,通过绿色通道进行高效开发和商业化的细胞免疫疗法。例如,Fate正在开发的候选产品ProTmune,FDA已经授予了ProTmune快速通道资格,并且FDA和欧盟委员会还分别授予了ProTmune的孤儿药产品称号。
不难看出,在全球还无iPSC衍生细胞治疗上市的如今,Fate拥有众多处于临床阶段的候选产品,其后续在iPSC细胞治疗领域的分量不可小觑。
目前,在全球范围内,有超过3000项干细胞临床治疗试验或案例。根据全球透明市场研究机构Transparency Market Research发布的报告显示,2025年底全球干细胞市场规模预计达到2705亿美元,近8年全球干细胞市场的复合年增长率有望达到13.8%。随着干细胞临床应用数量的显著增加以及慢性病新疗法的出现,未来几年全球干细胞市场将会迎来强劲增长势头。面对庞大的市场份额,不知Fate未来能占据“几席之地”?
但是,iPSC衍生的细胞疗法这条道路也并非一片光明、毫无困难,它还存在着一些目前待解决的问题。iPSC因为具有无限增殖的特性,细胞在移植后如果仍不断增殖的话,可能会导致肿瘤形成。iPSC衍生细胞免疫疗法还存在着免疫排斥的问题,这也是多数接受异体细胞移植后患者可能会面临的严重不良反应,甚至可危及患者生命。
另外,iPSC还存在着异质性问题,每个iPSC细胞系都与另一个细胞系在分化和增殖的过程中不完全相同,不同细胞系之间在形态、生长曲线、基因表达及分化倾向上的细微差别会带来不同程度的异质性,这种异质性最终可能会对iPSC产品的均一性带来障碍。
尽管iPSC还面临很多待解决的问题,但瑕不掩瑜,它所具有的巨大潜能,包括实体瘤、神经退行性疾病、糖尿病代谢病、心衰等领域的市场,才是值得我们想象的未来。
参考资料:Shinya Yamanaka.(2020) Pluripotent Stem Cell-Based Cell Therapy-Promise and Challenges.Cell Stem Cell 27(4),523-531.








 提供支持
提供支持




















