CD47单抗集体亮相SITC2020,天境生物同类最优初现端倪
PD-1单抗以其广泛的适用性和临床价值,成为了近几年医药行业的热点话题。从2018年底开始,四款国产PD-1单抗陆续上市,逐渐宣告PD-1单抗首轮竞争的终结,产品适应症扩张的军备大战正式开启。与此同时,医药产业则开始关注另外一个问题:谁会是下一个PD-1?
很多人将希望寄托在另一个免疫检查点靶点,CTLA-4身上,因为FDA已经伊匹单抗(Ipilimumab)和替西木单抗(Tremelimumab)两款产品获美国FDA批准上市。然而从目前为止的临床情况和销量上看,CTLA-4可能还难以接替PD-1的宝座地位。
2020年初,吉利德斥资49亿美元收购了CD47单抗先驱Forty Seven,让这一靶点再次转热;2020年下半年,天境生物与艾伯维就CD47单抗lemzoparlimab达成了总价值29.4亿美元的全球战略合作,直接将CD47靶点带回了医药产业的舞台中央。在最近的SITC(癌症免疫治疗学会年会)2020上,接连几家公司公布的CD47单抗临床试验结果,我们距离CD47单抗的上市,似乎越来越近了。
CD47靶点上一次登上“热搜”要追溯到几年前,但当时的热搜却不是什么振奋人心的消息。2017年底,Tioma(现更名Arch Oncology)终止了其CD47单抗Ti-061在欧洲的一项实体瘤临床试验;2018年底,新基制药(Celgene)悄然中止了其CD47单抗CC-90002用于治疗急性髓性白血病(AML)和高风险骨髓增生异常综合征(MDS)的临床试验。接连两个坏消息让人们对CD47靶点的价值产生了怀疑,甚至出现了“CD47败局已定?”这样的言论。
究其原因,CD47靶点在人体中的分布情况,导致这一靶点的创新药研发难度极高。
同为免疫检查点,CD47和PD-1之间的基础机理有一定共通性。CD47大量存在于肿瘤细胞的表面,当其与巨噬细胞表面的SIRPα结合时,会释放出“别吃我”的信号,防止巨噬细胞对肿瘤细胞的吞噬作用。因此阻断CD47的结合能力之后,巨噬细胞就可以正常的识别肿瘤细胞,将其吞噬、消灭。
这个故事听起来就像是把PD-1故事中PD-1换成了CD47,PD-L1换成了SIRPα,T细胞换成了巨噬细胞,如出一辙。因此从基础机理上看,CD47单抗确实有成为下一个PD-1单抗的潜力。
但是与PD-1不同的是,CD47除了在肿瘤表面有广泛分布之外,人体红细胞表面同样广泛表达CD47。因此如果只是简单的设计能准确识别靶点的CD47单抗,药物在靶向肿瘤的同时,还会将红细胞暴露在巨噬细胞的威胁之下,进而引发溶血性贫血。CD47靶点的成药性也因此一直被广为诟病。其面临的最大问题,不是药物的最终疗效,而是如何设计抗体,规避不良反应。
的确,Forty Seven 的magrolimab 差点胎死腹中。在一期爬坡试验中,在3mg/kg的时候出现了两个DLT。好在他们吸取教训,用预激给药的方法减低了重度贫血的发生,即所有患者均先接受1mg/kg的初始剂量,然后才开始给予既定的爬坡剂量。2019年底,Forty Seven率先交出了一份漂亮的答卷。在ASH 2019上,Forty Seven公布的1b期临床试验结果显示,在CD47单抗magrolimab与阿扎胞苷联合一线治疗AML/MDS中,MDS组有12例患者实现了完全缓解(CR),ORR达到92%;AML组有9例CR,ORR为64%。为了减轻药物的副作用,所有患者均接受了1mg/kg的初始剂量的magrolimab,并随着剂量递增,逐步增长到30mg/kg。从当时的统计数据来看,所有患者均耐受性良好。
Forty Seven给出的临床试验结果无疑是给市场的一针强心剂,意味着CD47靶点非但不是无法成药,反而有极高的临床价值。
虽然Forty Seven是第一个给出积极临床试验结果的企业,但却并不是CD47单抗研发路上的独行者。全球正瞄准着CD47单抗的企业有近20家,其中包括了多家中国创新药企业。
SITC2020上,天境生物、信达生物、康方生物等多家中国创新药企业给出了自己CD47单抗的答卷。其中刚刚与艾伯维达成合作的天境生物自然成了人们关注的中心,大家都很感兴趣,让艾伯维拿出近30亿美元的lemzoparlimab(TJC4)究竟表现如何?
天境生物从创始之初就一直关注CD47靶点,即使在这一靶点不被外界看好的阶段也从未放弃。天境生物董事长臧敬五博士曾在与动脉网的对话中表示,由于PD-1/PD-L1和CAR-T的爆红,创新药行业都在关注T细胞相关的疗法。所以天境生物四年前就制定了差异化竞争的路线,将自己的目光锁定在其他免疫细胞和改变肿瘤微环境相关的新靶点上。而CD47,作为调控巨噬细胞功能的重要通路之一,自然受到了天境生物的重点关注。
Lemzoparlimab在研发路上始终保持领先地位。在临床前实验中就表现出了与肿瘤CD47的高亲和力,并且与红细胞表面的CD47低限度结合。在临床前的食蟹猴毒理实验中,lemzoparlimab在重复给药高达100mg/kg的高剂量下,依然保持着良好的耐受性。
基于优秀的临床前实验结果,2019年1月,lemzoparlimab获得美国FDA临床试验许可,并在当年6月完成首例患者给药;随后不久,2019年7月,lemzoparlimab的1/2a期临床试验申请又被中国国家药监局(CDE)批准,并在次年4月完成首例患者给药。
Lemzoparlimab的迅猛进展很快被跨国药企察觉。在艾伯维重金押注之前,默沙东就先向lemzoparlimab抛出了橄榄枝。2019年9月,天境生物与默沙东建立临床合作伙伴关系。默沙东将自己的PD-1单抗明星产品Keytruda与TJC4一同开展联合治疗相关的临床研究。两代免疫检查点抑制剂的强强联合,着实令人期待。
到如今,TJC4的首个临床试验逐渐接近尾声,也让我们得以首次窥探其将提供的临床价值。与Forty Seven选择从血液瘤入手不同,天境生物直接指向难以攻克的实体瘤,与之正面对垒。在这项1期临床实验中,lemzoparlimab继续进一步证实了自己在临床前实验中验证过的良好安全性。
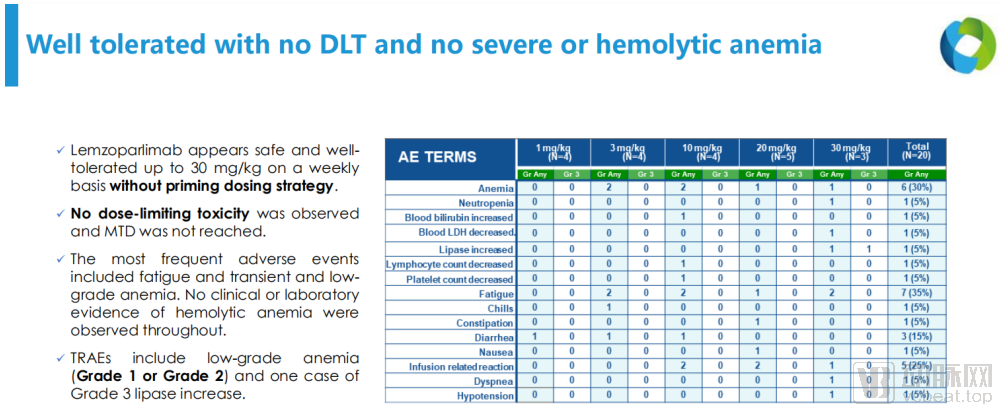
1期临床试验中的安全性相关数据
在没有任何预激给药的情况下,lemzoparlimab每周给药,从最低剂量(1 mg/kg)至最高剂量(30 mg/kg)范围内显示出良好的耐受性,在所有剂量组中均未观察到剂量限制性毒性和溶血性贫血。在中至高剂量,lemzoparlimab单剂注射的药代动力学特征呈线性,无明显抗原“沉没效应”。无剂量限制性毒性(DLT)事件发生。
正如我们此前分析的,在临床实验中实现安全性的验证,对于正处于研发阶段的CD47单抗来说,非常重要。所以lemzoparlimab在1期临床试验中表现出的良好安全性可谓是一颗定心丸。
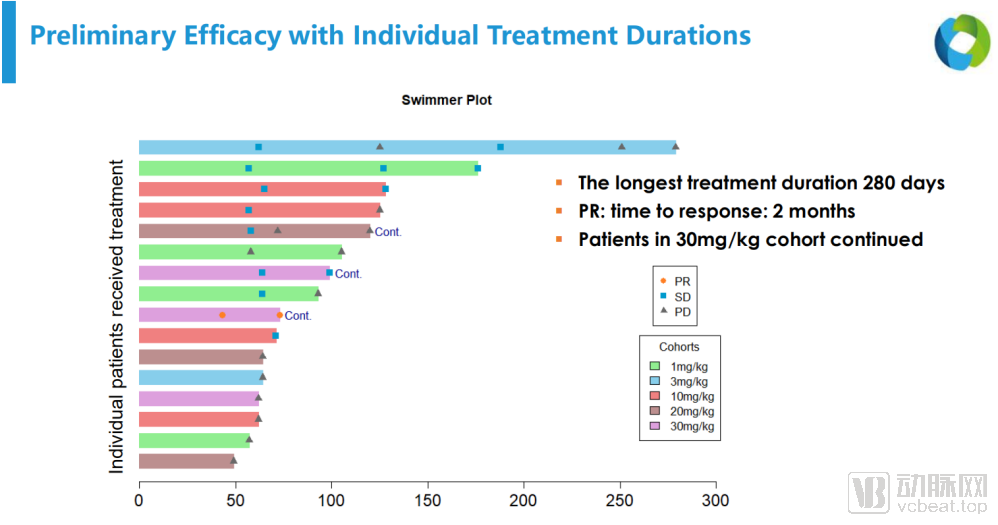
参与临床试验患者的治疗情况
同时在本次临床试验中,TJC4也初步展现出了自己的疗效。截止到2020年11月10日,所有患者中已经出现了1例PR(部分缓解)、3例SD(疾病稳定)。PR的患者为74岁男性,为黑色素瘤患者(肝转移),此前经过6个月Opdivo单药和Opdivo+Yervoy的联合治疗。Lemzoparlimab治疗第3个周期的第一天出现缓解,目前处于持续缓解阶段。
相较于此前已经公布的同类产品结果,lemzoparlimab凭借1期临床试验表现出的安全性和初步疗效从一众同类产品中脱颖而出,展现出自己“Best-in-Class”的潜质。
发展至今,天境生物沿着自己选择的路线,形成了自主研发+Licence in的双轮驱动发展模式。
创新药研发需要长时间的积累和漫长的临床试验过程。天境生物需要一个合适的途径来保证自己可以在自主研发的同时,获取一定的收入以平衡自己长期研发中的投入。大多数创新药企业都面临着相同的问题,不同企业在解决方案的选择上并不完全一致。有的选择与其他药企合作以分摊研发成本,有的选择开展仿制产品研发。天境生物则做出了从外部引入药物产品的战术选择。
凭借自己优秀的行业认知和项目发掘能力,天境生物瞄准国外创新药在国内外上市的时间差,通过合作引进全球经临床验证的优秀创新药产品,同时凭借自己在临床开发和注册申报能力上的优势,推动这些产品快速上市。这些引进药物产品将在短期内弥补天境生物自研产品上市周期长的缺点,帮助天境生物更早的进入盈利阶段。
天境生物CEO申华琼博士告诉我们,天境生物在引进产品上的选择有着一套自己的方法论:“从长远来讲,引进药物的主要目的是填充我们在自主研发过程的产品空窗期。在引进药物的时候,我们会根据自身特点去选择与我们的药物管线相匹配,能在我们的投资组合中体现价值,同时还要可以在较短的时间中在国内上市的新药产品。所以我们在引进目标的选择上是非常有针对性的。”
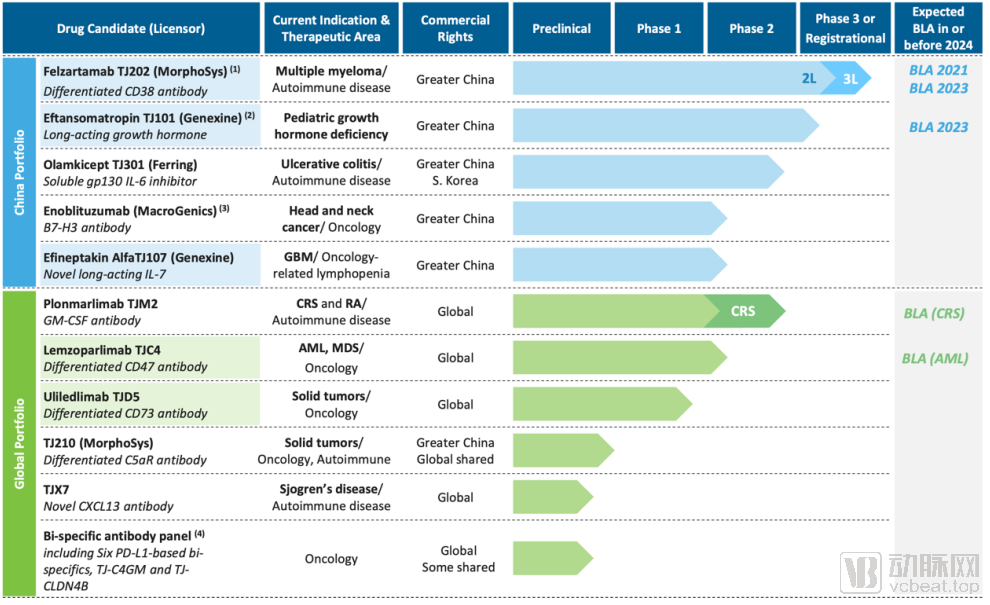
天境生物的管线情况
天境生物的引进产品管线目前都进展顺利,五条主要产品管线都已经顺利进入临床阶段。其中核心产品TJ202是一款潜在同类最佳的产品,针对的多发性骨髓瘤表面CD38抗原,已经进入了Ⅲ期临床阶段。如果研发进展顺利的话,天境生物或将推动TJ202于2021年申请上市。
在自研产品方面,天境生物拥有四个生物药开发的先进技术平台,分别用于研发单克隆抗体、双特异性抗体、HyFc融合蛋白和抗体-细胞因子结合物。在产品方面,三个进展较快的产品已经在美国开展临床试验。
事实上天境生物的自研管线发展速度本应比现在更快。但是在发展的过程中,天境生物选择性剥离了一部分产品管线,比如向乐普医疗转让PD-L1单抗,向石药集团转让hGLP-1-Fc融合蛋白产品TJ103,以及授权韩国生物技术公司ABL Bio双特异性抗体项目除大中华区以外的权益等。
这种抉择背后,其实与天境生物做高度差异化产品的初心紧密相连。天境生物对外转让的很多项目,并不是项目本身不好。尽管它们仍然是非常有价值的项目,但对于天境生物来说,这个项目已经与他们自身的定位不再相符,这时就会选择转让。
回到lemzoparlimab,目前为止仍然没有同类产品上市的CD47单抗,无疑是符合天境生物“高度差异化产品”的初心的。如今又展现出明确的安全性和临床价值,再加上跨国药企艾伯维在背后支持,lemzoparlimab显然已经成为了CD47单抗赛道上最具前景的产品之一。
对于CD47单抗的一系列竞争才刚刚开始,最终鹿死谁手还犹未可知。从目前的发展情况上看,国内创新药企业很有机会在这一靶点上拿下First in Class。目前处于领先杆位的天境生物也将携lemzoparlimab一同,成为这场竞争中的生力军,让中国的创新药变成世界的创新药。






























