本周新药数据共9个,其中肿瘤4个,免疫、代谢、感染、心血管和CNS各1个
❖基因编辑技术公司Sangamo与Biogen达成一项全球许可协议,双方将利用Sangamo专有的锌指蛋白转录因子技术(江湖人称金手指技术)合作开发神经退行性疾病的新型基因调节疗法,消息放出后Sangamo股价大涨40%,现市值约为10亿美元。此次合作协议的重点围绕Sangamo专有的锌指蛋白(ZFP)技术,被设计可以靶向特定的DNA序列,可抑制或激活该基因的表达。Sangamo在市场上也是极富传奇的一家公司,上市20余年,没有产品上市,但市值一直不低,而且通过垄断性的专利保护,导致其他公司无法染指其特有的金手指技术,但这也被诟病导致该技术发展缓慢。Biogen此前在AD领域几乎实现绝地翻盘,不知这次是否可以与sangamo成就一段佳话。
❖罗氏宣布将与英国生物技术公司Bicycle Therapeutics合作开发多肽免疫疗法,前者将支付3000万美元首付和潜在17亿美元的里程碑付款。Bicycle的核心技术是噬菌体多肽库的衍生化,即用一个化学三接头把噬菌体表达的直链多肽变成双环多肽,因此可以改变代谢稳定性、过膜性、和生物活性。近3年罗氏有成为收购届金主爸爸的趋势,从基因疗法、RNA、PROTAC、物理挤压细胞递送等前沿技术到抗生素、神经退行性疾病等都有涉及,2019年一天之内就与三家不同领域生物技术公司达成合作。现在新药开发领域的low hanging fruits已经摘完,但也没有任何一个新技术平台可以承载整个制药工业的发展、所以天女散花型的播种愈发成为巨型MNC的策略之一。
Mirati Therapeutics公布其在研蛋白激酶抑制剂与抗PD-1抗体联用,治疗晚期肾透明细胞癌的初步数据
Mirati Therapeutics公布其在研蛋白激酶抑制剂sitravatinib与抗PD-1抗体nivolumab联用,在1/2期临床试验中治疗晚期肾透明细胞癌(aCCRCC)患者时的初步临床数据
Mirati公司开发的sitravatinib是一款具有谱系选择性的口服受体酪氨酸激酶(RTK)抑制剂。它能够抑制几种类似的RTKs,包括TAM(Tyro3/Axl/MERTK)、VEGFR2和KIT
在这项1/2期临床试验中,截至2020年1月1日,38名患者接受治疗超过12周,并且可以被评估。这些患者曾经接受过靶向VEGF的靶向疗法,但是疾病继续进展
15/38(39%)的患者获得确认的部分缓解(PR),其中一名PR患者进一步改善至未确认的完全缓解(CR);35/38(92%)的患者疾病得到控制(疾病稳定+PR+CR);初步中位无进展生存期(PFS)为10.3个月
Sitravatinib与nivolumab的联用数据
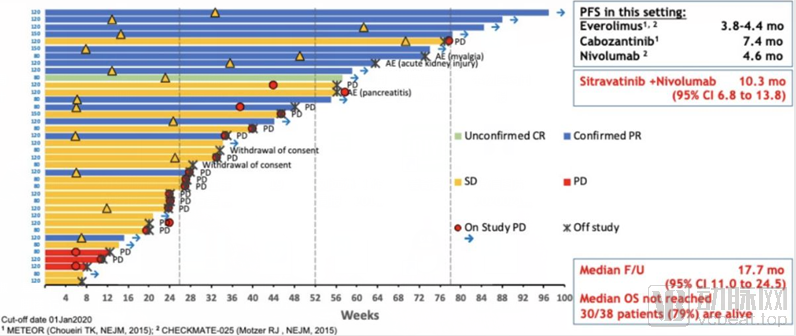 数据来源:mirati
数据来源:mirati
Debiopharm宣布FDA授予Debio 1143突破性疗法认定,用于一线治疗无法切除的局部晚期头颈部鳞状细胞癌
Debiopharm宣布FDA授予Debio 1143突破性疗法认定,用于和标准治疗联用,一线治疗无法切除的局部晚期头颈部鳞状细胞癌
Debio 1143是一款凋亡蛋白抑制因子(inhibitor of apoptosis proteins, IAP)的拮抗剂,能够通过促进细胞凋亡和改善抗肿瘤免疫反应,让肿瘤细胞对化学放射疗法(CRT)更为敏感
2期临床试验,通过观察18个月和2年的结果,看Debio 1143+CRT与CRT的对比
与对照组相比,治疗组患者在接受CRT治疗18个月后局部控制率改善21%。在接受治疗2年后,患者的疾病进展和死亡风险下降63%(p=0.007)
Biohaven宣布FDA批准CGRP受体抑制剂Nurtec口腔崩解片上市,用于急性治疗成人偏头痛发作
Biohaven宣布FDA批准CGRP受体抑制剂Nurtec(rimegepant)口腔崩解片(ODT)上市,用于急性治疗成人偏头痛发作
Nurtec ODT是rimegepant的创新快速溶解口服片剂配方。Rimegepant通过阻断CGRP受体,治疗偏头痛的根源
F关键性3期临床试验和长期开放标签安全性研究
在3期临床试验中,rimegepant达到消除疼痛和最困扰患者症状的双重主要终点。而且,只需服用一片rimegepant就可以获得这些效果,86%的患者在接受rimegepant治疗后24小时内不需要接受其它补救疗法(例如其它止痛药)
Esperion宣布FDA批准Nexlizet上市,治疗杂合子家族性高胆固醇血症和动脉粥样硬化性心血管疾病成人患者
Esperion宣布FDA批准Nexlizet(bempedoic acid/ezetimibe)上市,治疗杂合子家族性高胆固醇血症(HeFH)和动脉粥样硬化性心血管疾病(ASCVD)成人患者
Bempedoic acid是ATP柠檬酸裂解酶(ACL)抑制剂,能降低胆固醇的生物合成,从而降低LDL-C水平,ezetimibe抑制胆固醇运输蛋白NPC1L1的活性,降低胃肠道内胆固醇的吸收和向肝脏的胆固醇运输。这是首款降低低密度脂蛋白胆固醇(LDL-C)的非他汀类复方疗法
3期临床试验
与安慰剂组相比,Nexlizet与最大耐受剂量的他汀类药物的联用,使患者的LDL-C水平降低38%。Nexlizet计划于今年7月份在美国上市
GM Biopharmaceuticals宣布,其治疗NASH患者的主要候选药物aldafermin在2期临床试验取得积极数据
NGM Biopharmaceuticals宣布,其治疗NASH患者的主要候选药物aldafermin(NGM282),在2期临床试验第四队列的分析中取得积极的初步肝组织学和生物标志物数据
Aldafermin是人类激素FGF19的非致癌性、工程化改造的变体,通过靶向NASH的多种致病途径,显著降低肝脏脂肪含量并改善肝功能
在24周随机,双盲,含安慰剂对照组的2期临床研究中,78名经活检确认,伴有中度至重度(F2-F3)肝纤维化的NASH患者入组
治疗组中38%的患者达到≥第一阶段(stage 1)的显著纤维化改善,且NASH没有恶化,而安慰剂组中达到这一水平的患者比例只有18%。治疗组中24%的患者达到NASH的缓解终点,且纤维化没有恶化,而安慰剂组中的这一患者比例只有9%
诺华宣布FDA和EMA已接受其人源化CD20抗体Arzerra的BLA,治疗复发型多发性硬化症(RMS)患者
诺华宣布美国FDA和欧洲药品管理局(EMA)已接受其人源化CD20抗体Arzerra(ofatumumab,OMB157)的补充生物制品许可申请(sBLA)和营销授权申请(MAA),治疗复发型多发性硬化症(RMS)患者。
Ofatumumab是一款完全人源化的CD20抗体。它通过与B淋巴细胞表面的CD20结合,能够清除血液中B细胞,而这些细胞在MS患者中对激发自身免疫反应有重要作用
1882例MS患者参与的为期30个月的ASCLEPIOS试验,比较ofatumumab与teriflunomide治疗RMS成人患者的安全性和有效性
与活性对照组相比,ofatumumab在两项试验中分别使MS患者的ARR降低50.5%和58.8%。其延缓疾病进展的关键性次要终点也得以满足,与活性对照组相比,3个月后的MS确认残疾进展风险(CDP)降低34.4%,6个月后的这一数字为32.5%
武田宣布FDA已经接受该公司为Alunbrig递交的NDA,作为一线疗法,治疗ALK阳性非小细胞肺癌
武田宣布,FDA已经接受该公司为Alunbrig(brigatinib)递交的NDA,并授予其优先审评资格。这一申请寻求扩展Alunbrig适用范围,作为一线疗法,治疗ALK阳性非小细胞肺癌(NSCLC)
Alunbrig是武田开发的下一代酪氨酸激酶抑制剂(TKI),它的设计有针对性地靶向和抑制ALK融合蛋白
在3期临床试验ALTA-1L中,275名ALK阳性晚期或转移性NSCLC患者接受了Alunbrig或crizotinib的治疗。这些患者此前没有接受过ALK抑制剂的治疗
根据研究者的评估,Alunbrig组患者的无进展生存期(PFS)为29.4个月,而活性对照组的PFS为9.2个月。对于出现大脑转移瘤的患者来说,Alunbrig组的PFS为24个月,活性对照组为5.6个月。
ontraFect宣布FDA授予其exebacase突破性疗法认定,用于治疗由MRSA引起的血液感染
ontraFect公司宣布,美国FDA授予其exebacase(CE-301)突破性疗法认定,用于治疗由耐甲氧西林金黄色葡萄球菌(MRSA)引起的血液感染(菌血症),其中包括右侧心内膜炎患者的治疗
ContraFect公司开发的候选疗法exebacase是一种重组溶素(细胞壁水解酶),具有针对金黄色葡萄球菌的强力杀菌活性
一项2期临床试验对比了将exebacase添加到目前标准护理疗法(SOC)中,与单独使用SOC治疗的患者临床相比,缓解率方面的改善
在患有MRSA感染的患者亚组中,接受exebacase治疗的患者在第14天的临床缓解率比只接受SOC治疗的患者缓解率高42.8%(分别为74.1%和31.3%)。此外,exebacase的治疗还使患者的30天内全因死亡率降低了21%
Immutep宣布其LAG-3融合蛋白eftilagimod alpha与Keytruda联用,在2期临床试验中获得积极中期结果
Immutep公司宣布,该公司的可溶性LAG-3融合蛋白eftilagimod alpha(efti,又名IMP321),与默沙东(MSD)公司的重磅PD-1抑制剂Keytruda联用,在2期临床试验中获得积极中期结果
LAG3(lymphocyte activation gene 3,LAG3,CD223)是一种免疫检查点受体蛋白,主要表达在活化的T细胞、NK细胞、B细胞和浆细胞树突细胞
Eftilagimod alpha在名为TACTI-002的2期临床试验中,与PD-1抑制剂Keytruda联用,治疗不同类型的NSCLC患者,以及头颈部鳞细胞癌患者,参加试验的患者无需考虑其PD-L1表达水平
试验结果表明,在17名接受治疗的患者中,ORR达到47%。而且PD-L1表达水平不同的三类患者中都有患者出现缓解,8名出现缓解的患者中5名PD-L1表达水平<50%。
LAG-3作用机制
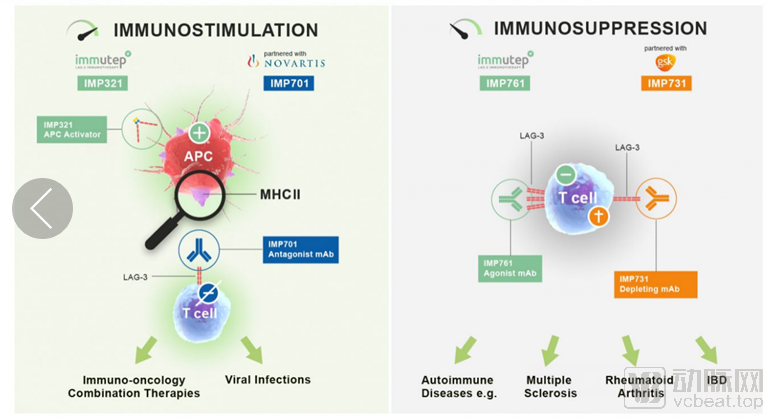
数据来源:immutep
❖关于COVID-19,2月29日新增确诊病例573例,新增死亡病例35例(湖北34例,河南1例),新增疑似病例132例,其中湖北新增确诊病例570例(武汉565例)。截至2月29日,现有确诊病例35,329例(其中重症病例7,365例),累计治愈出院病例41,625例,累计死亡病例2,870例,累计报告确诊病例79,824例
❖渤健(Biogen)和基因组学公司Sangamo Therapeutics联合宣布,双方达成一项全球许可合作协议。将利用Sangamo公司专有的锌指蛋白(ZFP)技术,并通过腺相关病毒(AAV)载体来调节与神经疾病相关的关键基因表达。共同开发和推广基因调节疗法ST-501和ST502(分别治疗阿尔茨海默和帕金森)
❖武田公司宣布,以约3.3亿美元的数额收购PvP Biologics公司,根据协议条款,PvP Biologics公司负责开发过乳糜泻(Celiac Disease)治疗药物TAK-062(Kuma062),直至1期临床验证。目前,TAK-062已完成1期临床验证,成功为武田的产品管线添加了第二种乳糜泻潜在疗法。
❖Bicycle Therapeutics公司宣布,与罗氏(Roche)旗下基因泰克(Genentech)公司达成一项战略合作协议, Bicycle将负责发现研究和早期临床前开发直至确认候选药物,基因泰克将负责候选药物的进一步开发和商业化。Bicycle公司将获得3000万美元的预付款,以及高达17亿美元的潜在里程碑付款