
2019.7.29-2019.8.4,本周新药数据共10个,其中5个为肿瘤,2个为CNS,2个为基因疗法,1个为代谢
❖第一三共开发的CSF1R抑制剂Turalio上市,这是首款获批的CSF1R抑制剂。国内有不少公司在布局CSF1R靶点,但是更多是看中其在单核吞噬细胞(尤其是巨噬细胞)的作用,思路是先天免疫与PD1这种后天免疫进行combo治疗肿瘤,不过在Five Prime的FPA008与opdivo在2017年年底公布的数据中,AEs非常明显,导致投资者开始重新反思CSF1R的作用机制。后续国内企业是否能在该靶点形成新的突破,有待进一步观察。
❖ 礼来公布了CDK4/6抑制剂与氟维司群联用显著提高HR+/Her2- 的晚期乳腺癌患者OS(绝经前和绝经后的患者都有获益),不过高兴不到一周,诺华也公布了类似结果。CDK4/6个很老的靶点,直到辉瑞在二期临床确证机理后引发高速竞争。不过Ibrance目前只显示能显著延长PFS,在若干临床试验中均错过OS终点。2018年Ibrance全球销售额约为42亿美元,Verzenio和Kisqali都在2.5亿美元左右,现在礼来和诺华先后证明在OS的获益,预计会强势侵蚀辉瑞的市场。
第一三共开发的CSF1R抑制剂Turalio上市,
用于治疗症状性腱鞘巨细胞瘤(TGCT)成人患者
美国FDA批准第一三共(Daiichi Sankyo)公司开发的集落刺激因子1受体(CSF1R)抑制剂Turalio (pexidartinib)上市,用于治疗症状性腱鞘巨细胞瘤(TGCT)成人患者
Pexidartinib是一款创新口服CSF1R小分子抑制剂。CSF1R介导的信号通路是驱动滑膜中异常细胞增生的主要因素
3期实验,总计120名患者接受了pexidartinib(n=61)或安慰剂(n=59)的治疗
39%接受pexidartinib治疗的患者在经过25周治疗之后获得缓解,安慰剂组这一数值为0%(p<0.0001)。患者的部分缓解率为23%,完全缓解率为15%
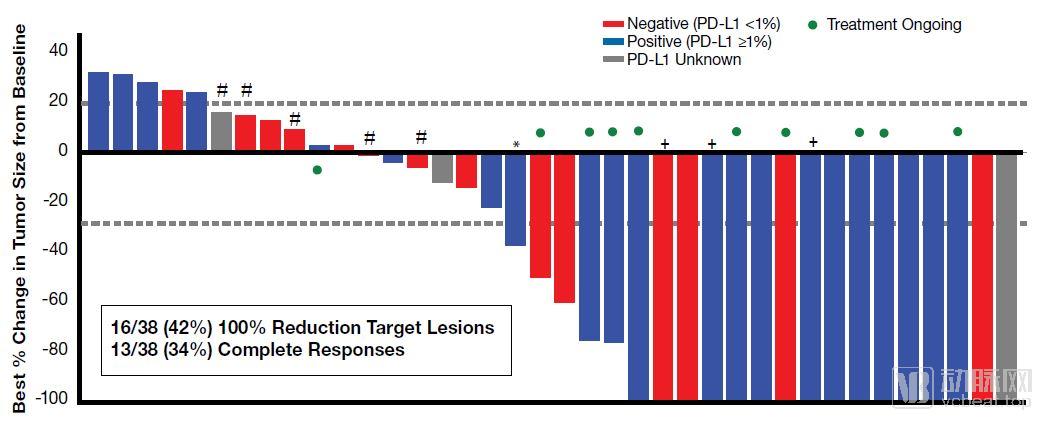
FDA授予Nektar的NKTR-214和BMS的Opdivo构成的
组合疗法突破性疗法认定,治疗黑色素瘤患者
FDA授予Nektar公司在研疗法bempegaldesleukin(NKTR-214)和BMS的PD-1抑制剂Opdivo(nivolumab)构成的组合疗法突破性疗法认定,治疗初治无法切除或转移性黑色素瘤患者
Bempegaldesleukin是一种IL-2信号通路激动剂,它倾向与CD122受体结合
治疗初治无法切除或转移性黑色素瘤患者,1/2期临床试验
组合疗法达到53%的ORR。而且在中位随访时间为12.7个月时,完全缓解率达到34%,随着随访时间的增加,获得完全缓解的患者比例也不断增加
NKTR-214和opdivo的联合疗法数据
 数据来源:ASCO
数据来源:ASCO
CDE公告由诺华递交用于预防成人偏头痛
的erenumab注射液获得临床试验默示许可
中国国家药监局药品审评中心最新公告,由诺华(中国)生物医学研究公司递交用于预防成人偏头痛的erenumab注射液获得临床试验默示许可
Erenumab是FDA批准的第一个预防性偏头痛治疗药物,2018年5月在美国获批上市,通过阻断降钙素基因相关肽(CGRP,一种参与偏头痛发作的分子)的活性发挥作用
在3b期试验中246名发作性偏头痛患者随机接受了每月一次皮下注射的erenumab或安慰剂治疗
接受erenumab治疗的患者中30.3%的人偏头痛发作天数减少了至少50%,对照组为13.7%
CDK4/6抑制剂Kisqali与fulvestrant联用,
在3期实验中显著延长了HR+/HER2-的乳腺癌女性患者的OS
CDK4/6抑制剂Kisqali(ribociclib)与fulvestrant联用,在治疗绝经后激素受体阳性、人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者的3期临床试验中,显著延长了患者的总生存期
Kisqali是一种选择性CDK4/6抑制剂,通过抑制CDK4/6两种蛋白,帮助减缓癌症进展
在MONALEESA-3中,484名绝经后女性患者被随机分配接受Kisqali+fulvestrant的治疗,242名被分配接受安慰剂+fulvestrant的治疗;在MONALEESA-7中,672名绝经前患者接受了类似的方案
在MONALEESA-3,接受Kisqali治疗的女性患者PFS为20.5个月,而安慰剂组为12.8个月;在MONALEESA-7中,接受Kisqali治疗的PFS为23.8个月,安慰剂组为13个月。
Amicus Therapeutics宣布其基因疗法在治疗CLN6 Batten病的
1/2期临床试验中,取得了积极中期结果
Amicus Therapeutics公司宣布,其在研AAV-CLN6基因疗法,在治疗CLN6 Batten病的1/2期临床试验中,取得了中止病情进展的积极中期结果
Amicus旨在通过使用AAV载体将功能正常的基因,通过鞘内注射运送到中枢神经系统内部,达到一次治疗就能长期,甚至终身缓解患者症状的效果
本次接受基因疗法的患者年龄在19个月到66个月之间
在接受治疗16到25个月后,8名患者中有7名的病情停止进展或稳定,表现为Hamburg评分不变,或上下浮动一分后稳定不变。而CLN6 Batten病患者,通常在头2年内,Hamburg评分至少下降2到3分。
拜耳(Bayer)公司宣布美国FDA批准Nubeqa上市,
治疗非转移性去势抵抗性前列腺癌(nmCRPC)患者
拜耳(Bayer)公司宣布美国FDA批准Nubeqa(darolutamide)上市,治疗非转移性去势抵抗性前列腺癌(nmCRPC)患者
Darolutamide是一款雄激素受体拮抗剂,能够与雄激素受体(AR)以高亲和力结合并且表现出强力的拮抗活性
在包含1509名患者的随机双盲,含安慰剂对照的3期临床试验中,患者接受darolutamide+ADT(雄激素剥夺疗法)或者安慰剂+ADT的治疗
Darolutamide治疗组患者的中位MFS为40.4个月,而对照组为18.4个月(p<0.0001)。Darolutamide将患者出现癌症转移或死亡的风险降低了59%
Alkermes和渤健(Biogen)公司宣布,一项治疗
复发缓解型多发性硬化症(RRMS)的3期临床试验获得积极顶线结果
Alkermes和渤健(Biogen)公司宣布,一项治疗复发缓解型多发性硬化症(RRMS)的3期临床试验获得积极顶线结果
Diroximel fumarate是一种口服富马酸盐(fumarate)的前体。它在体内能够被迅速转化为富马酸单甲酯
EVOLVE-MS-2是一项随机双盲,含活性对照,为期5周的3期临床试验,旨在评估与Tecfidera相比,RRMS患者使用diroximel fumarate的GI耐受性,包括持续时间和严重程度
因为AE退出试验的患者比例在diroximel fumarate组为1.6%,在Tecfidera组为6.0%。其中,因GI不良事件而退出试验的患者比例在diroximel fumarate组为0.8%,在Tecfidera组为4.8%
礼来宣布CDK4/6抑制剂Verzenio在
治疗HR阳性和HER2阴性乳腺癌患者时显著延长患者OS
礼来宣布CDK4/6抑制剂Verzenio(abemaciclib)在治疗HR阳性,HER2阴性晚期乳腺癌患者的3期临床试验中,显著延长患者总生存期
Verzenio是一款CDK4/6抑制剂。CDK4/6通过与D-细胞周期蛋白(cyclin)结合被激活
在MONARCH 2的随机双盲,含安慰剂对照的3期临床试验中,669名HR阳性、HER2阴性转移性乳腺癌患者接受了Verzenio+fulvestrant或安慰剂+fulvestrant的治疗
Verzenio+fulvestrant达到了总生存期的关键性次要终点
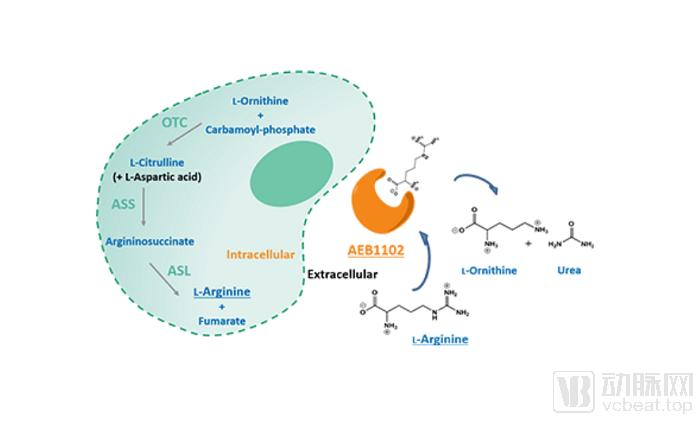
Aeglea BioTherapeutics宣布其在研疗法pegzilarginase获得突破性疗法认定,
用于治疗精氨酸酶缺乏症(ARG1-D)
Aeglea BioTherapeutics公司宣布,美国FDA已授予其在研疗法pegzilarginase突破性疗法认定,用于治疗精氨酸酶缺乏症(ARG1-D)
Pegzilarginase是一种增强型的人体精氨酸酶,可促进体内精氨酸代谢
1/2期临床试验及2期开放标签扩展试验
数据表明,pegzilarginase给药后患者的血液精氨酸水平降低并维持稳定
Pegzilarginase作用机制
数据来源:Aeglea
Editas Medicine和艾尔建(Allergan)联合宣布,
名为Brilliance的1/2期临床试验开始进行患者注册
Editas Medicine和艾尔建(Allergan)联合宣布,名为Brilliance的1/2期临床试验开始进行患者注册,这是世界上第一项CRISPR基因编辑在人体内进行的临床试验
AGN-151587(EDIT-101)是一款基于CRISPR技术的基因编辑疗法,它将编码Cas9的基因和两个指导RNA(gRNA )装载进AAV5病毒载体
开放标签的Brilliance临床试验计划注册约18名患者,入组患者将包括成年和儿科(3-17岁)患者。他们的一只眼睛将接受一剂AGN-151587的视网膜下注射
后续待公布
❖安进(Amgen)公司在2019年第二季度财报的电话会议上公布了该公司的KRAS G12C抑制剂AMG 510的最新研发进展。AMG 510不但能够在非小细胞肺癌(NSCLC)患者中产生疗效,也能为结直肠癌(CRC)患者和阑尾癌(appendiceal cancer)患者带来部分缓解
❖专注于癌症筛查技术的Exact Sciences公司和基因检测公司Genomic Health公司宣布,双方将合并成为一个新的大型癌症诊断公司。这一合作金额高达28亿美元
❖迈兰(Mylan)公司和辉瑞(Pfizer)公司宣布达成一项最终协议,迈兰公司将与辉瑞旗下专注于非专利品牌和仿制药业务的辉瑞普强(Upjohn)公司合并,创建一家新的全球性医药公司,致力于造福全世界患者
❖默沙东公布了2019H1业绩,全球销售收入225.75亿美元,其中Keytruda上半年营收49.03亿美元,大幅赶超O药,预计今年将正式入围百亿美元俱乐部
❖ 日本批准了第一例人兽杂交胚胎实验,预计用于器官移植。该试验的研究者为东京大学医学科学所的教授中内啓光,他同时也是斯坦福大学教授






























