生物标志物的发展与药物的研发并没有什么直接联系,但他们在每一个发展阶段 ,从探索性实验室研究到临床试验再到真正被治疗应用,都存在着标志性的的重合。
随着医学发展更加个性化、更依赖于分子水平的研究,基因组和蛋白质组学研究已经证明,药物研发和生物标志物发展之间的重合也呈必然的增长趋势 。
分子生物学方法(主要是基因组和蛋白质组学技术)并行跟踪多个生物分子的能力正在逐步提高。 因此, 潜在的生物标记特征鉴定方法也正朝着简易化的方向发展,该方法可以作为客观地检测评估正常生物进程、病原进程或药理应答的指标(针对治疗干预)。
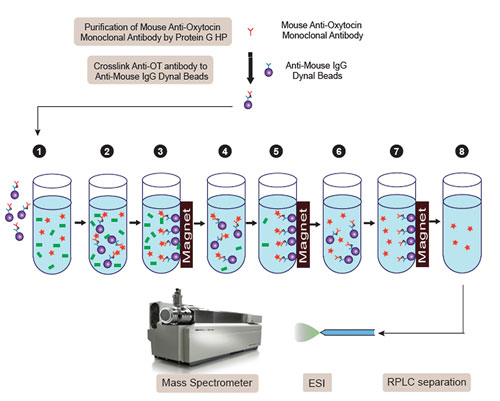
这是辉瑞公司使用混合技术来进行生物标记物测定的实例。将一个纯化后的单克隆抗体与磁珠相连,然后加入样品中。 再使用分离磁场来分离出目标蛋白质或肽。 最后通过液相色谱 - 质谱(LC / MS-MS)的手段进行进一步分析。
应当引起注意的是,生物标志物的定义不只包括于基因组和蛋白质组特征的生物标志物,它还包括其他类型的生物标志物: 生理测量标志物(例如血压)、成像结果(例如放射照片获得)和基本血液分析物(例如葡萄糖水平),将其组合使用可以使评估结果更加准确,同时也能增加研究人员或监管机构对候选生物标志物的信心。
但目前最关键的问题是:我们如何确定每一个特定生物标志物是否都拥有其特定的可靠指南来实现特定的需求?因为当我们运用生物标志物时,有给予了不同程度程度的信任,而每一个生物标志物都有其适合的特定的目的需求。例如,“适合目的”标准足以满足研发人员的内部审议,或足以达到发布研究结果的要求。如果生物标志物要实现验证或鉴定,必须符合更严格的标准。 “
生物标志物的应用
生物标志物的应用范围广泛,从建立诊断和预后症状筛选,再到药效的预测,可以看作是临床研究中的替代终点指标。
Shire的医学总监Mahmoud Loghman-Adham博士说:“临床生物标志物必须非常简单且稳定,才能满足在医院实验室中使用的要求。 例如,在研究中效果很好的质谱分析法就因为特定性太强且价格昂贵而不适合在临床环境中使用。“
“大约在10年前,生物标志物的发展还未起步。但现在,生物标志物已经开始了临床前期的研究,从动物模型开始,再到临床研发阶段。
“在症状变得在临床上体现得越来越明显之前,人们对寻找预测疾病发展风险的生物标志物有很大的兴趣。鉴于早期干预治疗对癌症和心脏问题的疗效,和肾脏疾病一样,这是目前最受欢迎的方向。
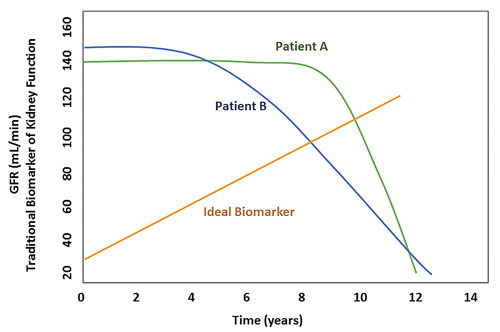
这是理想生物标志物水平的变化与肾功能的传统标志物水平的变化(例如肾小球滤过率(GFR)或血清肌酐)的比较。 传统标记物的变化通常在疾病晚期发生,此时可能已经出现了不可逆的损伤。 [Mahmoud Loghman-Adham,M.D.,Shire]
从Loghman-Adham博士的话中我们可以看出,如果有适当的可以使用的生物标志物,就可以更快地开展临床试验或临床治疗 。例如,如果生物标志物可用,就能使医生们追赶上早期急性肾损伤的病势,以开展治疗行动。
目前,肾脏疾病的检测主要依赖于“传统的”实验室检查,比如BUN(血尿素氮)和肌酸酐水平的检验。但不幸的是,在损伤发生后很长一段时间后这些测试才能检测出问题。
尽管有这些限制,但Loghman-Adham博士的仍然保持着乐观的态度。他指出,“血液和其他体液样本的生物样本库是一个丰富的来源,可以用以开发和验证新的潜在生物标志物的各种疾病,” “同时对患者信息标识,然后得到患者的同意以存储几年的样品用于进一步的研究。
“欧洲有数百个公共资助的生物标志物项目,用以医疗方面的决策支持,其最终目标是为患者制定个性化的治疗方案,”图宾根大学自然医学科学研究所副主任Thomas Joos博士说道。 “新的生物标志物将更好地预测药物反应,并能为每个患者都选择最佳治疗方案。”
“该项目需要结合稳健的测定技术、固体测定法和高质量样品,用于生物标志物的开发和验证项目。进行简单的数据分析。具体来说,我们寻找的是可以指示疾病早期阶段的生物标志物。理想的情况下,在健康的身体条件下这样的生物标记物是不会存在或不增加的。
“生物标记物的鉴定过程是对资源和的时间的双重消耗,需要仔细选择有代表性的样品组。因此,这些项目在私人的和公共合作的组合中实现的话取得成功的几率更高。
Joos博士指出,在欧洲,欧盟和欧洲制药业之间就存在着公私合作伙伴关系,称作创新药物倡议(IMI),其有助于加速为患者开发更好、更安全的药物。
Joos博士解释说:“IMI通过支持工业界和学术界之间的合作研究项目以加速药物开发进程。 此外,IMI还支持生物标志物的研发工作,如使生物标志物被用于评估药物诱发的器官损伤的IMI SAFE-T项目。”
在美国,类似的工作由预测安全测试联盟(PSTC)承担。该组织将制药公司都联系在一起,在FDA、欧洲药品管理局(EMA)和日本制药和医疗设备局(PMDA)的指导下共享和验证创新的安全测试方法。截至目前,PSTC已经商讨出了一组可以指示肝损伤的蛋白质。
Joos博士指出:“在查看基因组数据时,我们看不到细胞的活性。 “用免疫测定技术来研究蛋白质为生物标志物候选物提供了优质的来源,并能观察到更加细致的细胞活性。“
辉瑞公司临床分析组的高级经理、生物标志物测定专家Jenny Y. Zhang博士说:“通过开发和验证生物标志物的测定来支持临床试验,面临着诸多挑战。 “符合FDA指南是成功开展生物分析测定的关键,同时对监管机构保持开放的沟通渠道对于成功的生物标记物开发也至关重要。
“我们组主要使用的是药效学(PD)生物标志物,该标志物可以证明药物与其追求的的生物学效应之间的联系。近年来,大家都对生物标志物的研究给予了高度的重视,因为生物标志物在决定继续或放弃一个项目上发挥关键作用。“
“辉瑞开发并验证了临床试验的PD生物标志物分析测定。通过验证生物标志物分析测定所产生的数据,常常在临床试验中选择新药物的适当剂量被用来参考。而通过生物标志物数据也可以讲机制的证明与概念证明相关联,“Zhang博士说。
“产生生物标志物数据的多变性的原因很多:生物标志物的固有性质、一位患者和一群患者之间的变化、药物是否随食物一起被服用、生物标志物的昼夜节律。因此,在开始临床试验之前的要做的就是进行一个验证生物标志物的分析测定。该分析方法需要区分正常样品和疾病样品,并对从一个状态到另一个状态的进展进行评估。
张博士认为,由于存在一些技术性的问题,要实现生物标志物的准确测量具有一定的挑战性,这是因为没有空白基质样品存在也没有内源性分析物,所以给替代基质的选择带来了很大的挑战。
此外,在体内可以发现相同蛋白质的几种同种型,这可能混淆生物标志物测定。这也是另一大挑战。我们可以通过将几种技术结合分析来解决这个问题。
“只使用质谱仪来定量血清中催产素的水平是不能达到理想的灵敏度的,然而采用抗体定量专一性要不够高,”张博士解释说。 “但将抗体识别和磁珠技术结合,从血清中富集和分离催产素,我们就可以使用混合质谱方法来进行选择性的、精确地测量血清催产素。
但是样品完整性又是另一个问题,在样品处理的细节上尤其需要注意。怎样在收集样品后快速冷冻?用作生物标志物的蛋白质或肽在样品收集后是否可以进一步的生物降解?临床前生物标志物可以转化为实际的临床应用吗?我们可以在可用和有用的目标基质中测量分析生物标志物吗?
所有这些问题都必须在开始临床试验前进行调研并解决,特别是当生物标记数据被用于实验中的初级和次级终点时。用于内部决策的探索性生物标志物的测定不需要经过临床生物标志物测定的严格验证。
对于那些希望构建具有多重能力的生物标记物测定的人来说,他们可从Meso Scale Discovery(MSD)的分部获得援助。该公司还提供一项开发生物标志物分析的服务,MSD的营销副总裁Fiona Coats博士说道。
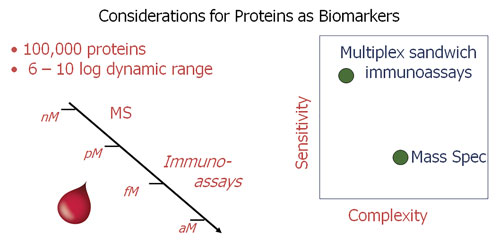
样品中目标蛋白质的浓度是靶标验证的关键方面。 在血液中,约100,000种蛋白质的浓度都分布在一个大范围内 - 通常为6至10个数量级的区间。 最新的生物标志物在该区间的较低端; 因此需要基于免疫的测定来达到理想的灵敏度。
“通常,我们在这一领域的客户都是大型制药或生物技术公司,”Fiona博士说道。 “我们与客户合作的服务范围包括从测定开发的初始阶段到为他们提供一个或多个生物标志物的验证测定。
“我们的专业长是运用我们在电化学发光(ECL)的知识来开发一个稳健的分析测定方法。科学家使用我们的分析测定法可以在复杂样品基质中获得精确的可实现重复测量的蛋白质。
大多数人都开始使用蛋白质来作为生物标志物了,但也有使用DNA或RNA作为生物标志物的趋势。 Meso Scale Discovery提供的定制包被板在被修饰后可用以检测核酸。
Meso Scale Discovery最近建立了U-Plex®,这是一个允许人们设计属于自己的多重测定法的平台。至关重要的是,当商业化验不可用时,其允许研究人员选择他们自己的小组来建立生物标志物分析测定。 U-Plex平台旨在帮助客户创建自己的生物标志物组,同时允许根据物种,抗体和数量进行定制。U-Plex与MSD的Multi-Spot®免疫测定板一起使用,支持96和384孔格式的多重测定。
“MSD Multi-Spot®板的特点是,每个孔都有10个独特的点,可以测量10种不同的分析物,”Coats博士详细说明。 “MSD的平台有助于在生物标记物开发中的复用和重现性挑战的攻克。
我们在读板器中使用位置照相机来确定来自孔中的10个点中的每一个的信号。 ECL技术的背景和交叉信号非常低因此高灵敏度很高。许多用于商业用途的ELISA在本质上是分析试剂盒,并且不允许在皮克级水平的蛋白质浓度下进行检测。
一家生物库表示,Meso Scale Discovery的技术允许在一个孔里有多个目标的广泛的动态范围条件下进行测量。这对那些样本量有限的客户来说是非常有利的。
生物标志物验证的关键是严密性。虽然存在着这些挑战,但是在被应用于各种用途的的生物标志物在表征和鉴定方面都取得了很多进展。
Shire的医学主任Mahmoud Loghman-Adham博士说:“必须小心区分验证和资格鉴定。 因为生物标志物验证和资格鉴定都有定义精细的调控途径。
据一篇综述(Hunter et al.,Current Drug Targets)显示,验证是一个评估生物标志物及其测量性能特征的过程,并且能确定生物标志物的重现性和准确性数据的条件范围,而鉴定是将生物标志物与生物过程和临床终点联系起来的证明过程。简而言之,验证是关于生物标记的性能指标,而鉴定是关于生物标记的资格认证。
“验证是表现生物标志物对有问题的诊断、预后或临床终点进行准确预测的过程,”Loghman-Adham博士解释说。 “资格要求与监管卫生机构(如FDA)一起完成。这是一个耗费精力的过程,通常需要在学术界和工业界之间形成一个联盟,才能使生物标志物的运用实现。
FDA已经为生物标志物的验证和资格鉴定制定了详细的指南。例如,在2013年,FDA通过发布包括生物标志物和诊断的指南草案更新了其生物分析方法验证文件。此外, FDA还建立了生物标志物资格认证计划,其处理针对药物开发中特定“使用背景”的生物标志物的监管资格的请求。一旦一个生物标志物通过该审批流程,就可以被用于临床试验,作为伴随诊断以及用于其他基于医疗健康的应用。






























