从人类首次使用间充质类细胞(Mesenchymal Stromal Cell,MSC)进行疾病治疗到现在,已经历经将近30年历史。间充质类细胞在抗炎修复等方面有着独特的治疗优势,它来源广泛、安全性高、免疫原性低,可以实现体外规模化扩增,因此被认为是非常有潜力的细胞疗法之一。
目前,国际上已经获批上市的间充质类细胞产品有十余款。最近几年,日本、加拿大、印度和欧洲相继批准了间充质类细胞药物上市,诸如用于治疗急性移植物抗宿主病的JCR制药Temcell产品,用于治疗克罗恩病的武田制药Alofisel产品等。
还有诸多间充质类细胞药物进入Ⅲ期临床试验。据统计,间充质类细胞已成为全球开展临床研究项目数最多的细胞,相关临床试验已经超过1300项,用于治疗各种疾病。
不过,值得一提的是,美国FDA至今仍未批准任何一款间充质类细胞作为药物上市销售。最近,FDA通知Mesoblast公司,认为其Ⅲ期临床研究数据足以支持其提交Remestemcel-L(源自骨髓的同种异体间充质类细胞疗法)的生物制品许可申请(BLA),Mesoblast计划将在今年第二季度再度提交BLA。但在此前, FDA曾两度驳回Mesoblast公司Remestemcel-L的上市申请,要求提供更多临床支持数据,并希望在开展新的临床试验之前先解决Remestemcel-L的CMC问题。此次获准提交BLA申请,Remestemcel-L的CMC问题依然是一场考验,最终能否解决值得关注。关注MSC疗法的华尔街媒体指出Cynata公司基于人诱导多能干细胞iPSC平台的MSC产品可能是解决CMC问题的答案1。目前大部分已获批上市的间充质类细胞产品,主要是根据其免疫调控和促进受损组织修复的两个药物作用机制来选择适应症,如移植物抗宿主病、膝骨关节炎、克罗恩病、严重下肢缺血等。市场定价基本都在每剂几万到十几万美金不等,费用极其昂贵,已上市产品的市场销售情况尚不乐观。
同样,迄今为止,中国国家药品监督管理局(NMPA)也尚未批准任何一款间充质类细胞药物上市。
除了尚未突破的监管环境外,间充质类细胞的生产工艺也面临挑战。目前,临床使用的MSC种类各不相同,多年研究结果提示不同组织、不同供者来源的MSC具有显著的差异性,治疗各种疾病的临床表现也不尽相同。因此,如何实现批间一致、质量可控的规模化生产是实现MSC成药的关键环节。
面对这些挑战,动脉网邀请到hiPSC技术全球开创者之一、中盛溯源创始人俞君英博士,共同探讨间充质类细胞疗法的挑战,以及未来更具可行性的成药之路。

hiPSC技术全球开创者之一、中盛溯源创始人俞君英博士
本文为俞君英博士系列专访第三篇,前两篇详见:
应对间充质类细胞疗法监管挑战,质量和疗效稳定是关键
动脉网:在您看来,iPSC衍生MSC相较于成体来源MSC有哪些优缺点?
俞君英:iPSC衍生MSC能够批量生产,并保证批次间细胞数量和质量稳定。还有一个主要特色是,iPSC衍生的MSC跟胎儿期的MSC更类似,是最“年轻”的MSC。
另外,从iPSC细胞分化得到的MSC其实是一类细胞,不同分化路径生产出来的细胞的特性是不一样的。虽然说大家生产的都可以称为MSC类细胞,但是实际的疗效和可有效针对的适应症并不相同。
动脉网:您如何看待间充质类细胞疗法的监管问题?澳洲Mesoblast公司的间充质类细胞产品在美国FDA二次递交NDA失败,近期获准提交BLA申请,您认为这反映了间充质类细胞疗法的哪些现实处境?
俞君英:Mesoblast的间充质类细胞疗法Remestemcel-L针对的适应症是12岁以下儿童的激素难治性急性移植物抗宿主病(SR-aGVHD),他们采用骨髓来源MSC。实际上,MSC治疗GVHD的疗效是非常明确的,使用MSC产品的GVHD患者的存活率要比不用的高很多,而根据Cynata公司发布的数据,iPSC来源的MSC可能比骨髓、脂肪等来源的MSC疗效统计数据更好。Mesoblast在2023年的BLA申请被FDA拒绝,不仅是要求补充新的临床数据,也提出了CMC的问题,也就是细胞来源,无法保证不同供者骨髓来源的MSC的质量一致。最近Mesoblast被FDA同意使用一项纳入了54例儿童的单臂III期临床试验的数据用于支持BLA的申报,我们也在持续关注,期待监管取得突破。
多能干细胞来源的MSC可以无限量制备生产且每批次得到的细胞质量更加稳定均一,但是从骨髓来源的话,一个人身上可以拿到的细胞数量有限,而且不同人骨髓得到的MSC细胞质量和疗效都是不稳定的。这也是现在国外很多产品在上市以后市场表现不好的一个根本性原因,细胞产品质量和疗效都不稳定,但是价格又远高于其他治疗手段,这就决定了它们比较一般的市场表现。
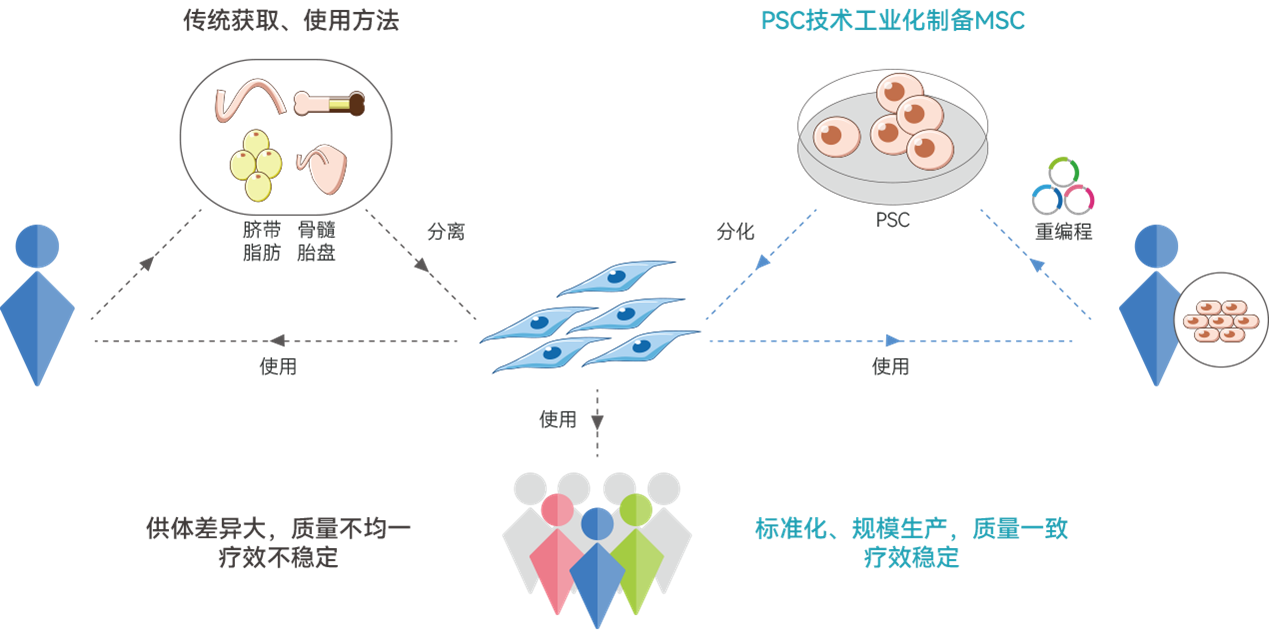
成体来源MSC细胞疗法 vs. 多能干细胞来源MSC细胞疗法
动脉网:虽然全球间充质类细胞产品的研究已经很多年,但是以药品形式上市的仍为少数,其中的原因是什么?
俞君英:在国内,各家医院用间充质类细胞治疗患者很多年了,相关的间充质类细胞临床研究也非常多,但是最后并没有得出明确的结论,究竟间充质类细胞对哪种适应症有效,得到的数据结果尚不具备统计学意义,关键原因就在于这些间充质类细胞产品的CMC不稳定,临床上的有效率和疗效波动较大。
动脉网:针对iMSC管线,目前国内外都有哪些企业进行了布局?
俞君英:国际上,澳洲Cynata Therapeutics进行了布局,他们的Cymerus MSC疗法在移植物抗宿主症、膝骨关节炎、糖尿病足等适应症上分别处于临床I到III期阶段。国内,目前我们的iMSC产品获批进入临床试验,适应症是膝骨关节炎。
和iMSC类似的还有人胚胎干细胞hESC分化得到的MSC类细胞产品,国际上有美国ImStem Biotechnology公司的“hES-MSC”产品,国内有泽辉辰星的“CAStem 细胞”,也都分别在不同适应症上进入了临床试验阶段。
探索iMSC成药之路,优化CMC环节、获取客观充分的临床数据至关重要
动脉网:中盛溯源的iMSC管线是在何时立项的?公司在调研立项时做了哪些工作,为何优先选择膝骨关节炎作为适应症?
俞君英:iMSC管线在公司2016年成立之时就已经立项了。做产品和做科研不一样,科研可以高大上,但是产品其实越简单才越容易实现。在iPSC成药方面,间充质类细胞在技术上已经比较成熟。在临床端,MSC属于一过性产品,并不长期在体内滞留,并且确实在抗炎和修复上很有效。这么多年来,在国内,间充质类细胞疗法针对不同适应症的疗效是可以肯定的。核心问题在于要把MSC的质量给稳定下来,所以这是我们当时立项iMSC的一个最主要考虑点。
至于为何选择膝骨关节炎,首先膝骨关节炎患病率高,大多数40岁以上人群的膝骨关节都会有些问题,目前针对膝骨关节炎还没有有效的疗法,而间充质类细胞治疗膝骨关节炎的疗效是非常明确的,这意味着iMSC管线的前景是比较广阔和明确的。
iPSC衍生iMSC
动脉网:2022年获批临床后,中盛溯源的iMSC管线成为国内首款且唯一一款获批临床的iMSC细胞药物。立项后,中盛溯源在获批IND方面都做出了哪些努力,与国家药监部门进行了怎样的沟通?其中遇到过哪些困难,又是如何解决的?
俞君英:这是我们第一个获批临床的产品,当时立项除了考虑临床需求、技术、专利等因素以外,还要考虑监管部门的接受度。监管部门对脐带来源、骨髓来源的间充质类细胞疗法很熟悉,接受度也比较高。所以在我们看来,iPSC来源的MSC得到监管认可的可能性会比其他iPSC来源的细胞种类要高。这也是我们把iMSC作为第一条管线的原因之一。
我们公司在国内算比较早布局iPSC临床应用的,开始时大家对这个领域不太熟悉。在立项之后,我们的iMSC管线也经历过一些坎坷。因为从iPSC细胞成药来说,CMC涉及的多个环节都是全新的,它不像小分子、抗体药等有比较标准的生产工艺和质量控制体系,iPSC生产MSC非常复杂,包括了重编程、建库、生产、质控、建立质量标准等多个环节,监管机构和产业界都是在摸索学习的过程中,像美国的FATE公司的iNK产品也很可能来回蹉跎了好几年,才最终获批首个IND。
在这种情况下,针对CMC到底要怎么做、生产过程如何控制、需要做哪些检测等问题,我们花了两年多的时间跟监管机构不同部门进行了非常多的交流,在不断的沟通中逐步得到了一些相对明确的答案。所以这条管线虽然立项很早,但真正IND获批已经到了2022年了。
动脉网:间充质类细胞疗法目前在全球已有上市产品,临床试验竞争也较为激烈,您认为,iMSC产品将凭借哪些核心竞争力在全球竞争中脱颖而出?
俞君英:目前间充质类细胞药物主要是在欧美、日韩上市,在中国还没有一款相关疗法上市的,还都在临床试验阶段。
我们通过iPSC技术分化生产间充质类细胞,能够做到规模化生产和质量稳定,这样就能解决FDA对Mesoblast提出的突破每次骨髓捐献仅支持500剂生产等CMC问题。另外,我们筛选出来的iMSC分化工艺可以使得到的iMSC产品的免疫调节能力更强,在特定适应症上已经看到,使用成体MSC治疗无效的患者对iMSC反应良好药效显著。
因此,在进入商业化规模生产之后,我们可以在保证质量稳定的前提下,大规模生产疗效更有优势的产品来竞争。
动脉网:未来iMSC管线的申报上市将采取什么样的策略来保证?
俞君英: iMSC管线的临床研究会采用明确的统计学数据来证明它是否对特定适应症有效。
我们现在能通过iPSC技术来批量生产MSC,按照药品标准保证细胞质量稳定,然后再统计临床数据。目前基于优化后工艺来生产的iMSC跟脐带等成体来源的MSC细胞还是不一样的。针对不同的适应症,我们除了IND临床试验之外,也在进行一些适应症的探索,后面我们再去做这些适应症的注册临床研究,就可以明确我们的iMSC对某个适应症是否有疗效,疗效是否优于现有指南疗法和正在开展临床试验的新药。如果是成体来源的MSC的话,本来临床上患者的情况就千差万别,不同医院的诊疗流程也不一样,再加上细胞治疗产品不同批次或不同供者引起的质量差异,最后得到显著的统计学数据难度会非常大。
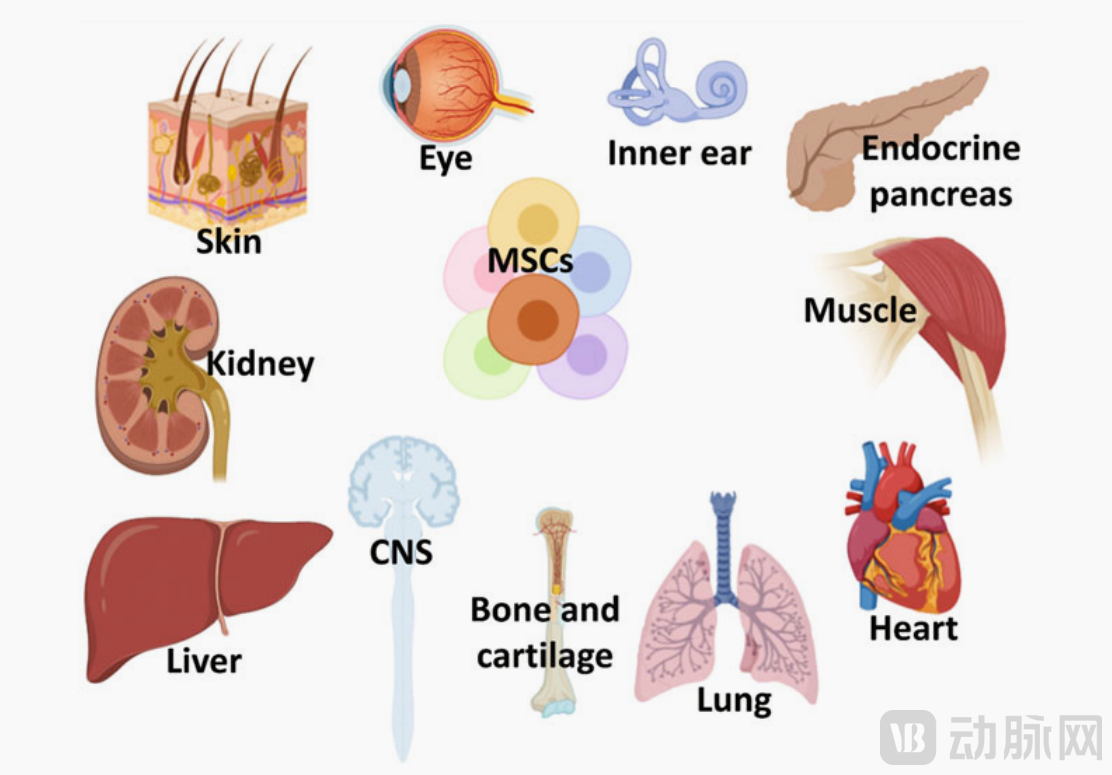
MSC可用于治疗涉及多个器官的各种疾病2
动脉网:目前iMSC在抗炎修复领域的最新管线进展如何?未来5年预期会迎来哪些里程碑式进步?
俞君英:目前,iMSC针对膝骨关节炎(KOA)的管线已经进入临床Ⅰ期阶段,安全性良好,有效性待观察积累数据。iMSC用于其他适应症的治疗正在开展IIT研究。
我们预计在未来几年内iMSC以及基因修饰iMSC产品在抗炎修复领域会有一系列成果出现。除了已经进入正式临床的针对膝骨关节炎的产品,针对一些危重疾病和罕见病的iMSC产品也陆续在IIT研究中显现出来不错的进展,在其他适应症上的加强型iMSC的拓展研究也在继续。我们会保证安全的前提下,找到iMSC最有效的适应症,以此为基础将逐步实现iMSC的成药。
结语
间充质类细胞疗法被认为是一种具有前途的细胞疗法,不过,由于CMC挑战、疗效尚不明确,一直面临市场疑虑。iPSC来源的MSC因为能够在规模化生产的同时保证细胞质量稳定而被赋予了更多治疗希望。然而,前路仍需探索,虽然是能够实现MSC成药的理想路径之一,但在生产工艺、临床疗效、适应症方面的开发和研究,依然至关重要。
俞君英博士系列专访文章
1. 专访hiPSC技术国际首创人之一俞君英博士:实现iPSC细胞治疗成药性的关键何在
2. iPSC衍生NK细胞疗法未来路在何方?——专访hiPSC技术全球开创者之一俞君英博士
参考资料:
1. https://seekingalpha.com/article/4378377-mesoblast-needs-solution-to-msc-scalability-issues-cynata-therapeutics-answer
2. Adv Exp Med Biol. 2021:1312:107-129.








 提供支持
提供支持