
匹兹堡大学的鲁兴华教授和匹兹堡大学医学中心(UPMC)的孙旻教授认为“机器学习赋能的基因检测和分析能有效提高结肠癌化疗用药的准确性。在目前结肠癌辅助治疗场景下,应用奥沙利铂可以减少5%病人的癌症复发,但会在约90%病人诱发神经毒性,这个收益风险比(benefit-to-risk ratio)显然是不利于大多数病人的,亟待改善。”
消化道肿瘤约占全部肿瘤类型的四分之一左右,而其中结直肠癌恶性肿瘤最为严重。根据2021年《Chinese Journal of Cancer》发表的数据显示,中国人群结直肠癌恶性肿瘤的死亡率位居第三,仅次于肺癌和胃癌。而在世界范围内,世界卫生组织国际癌症研究机构(IARC)在2021年预测全球结直肠癌新发患者会从2018年的180万,增加到2070年的470万。在所有癌症类型中,结直肠癌的新发预期增幅最大。
早期的结肠癌患者通常会在手术治疗后接受辅助化疗,其目的是降低肿瘤复发风险。在上世纪90年代,由氟尿嘧啶(fluorouracil)+ 亚叶酸(leucovorin)构成的组合(FULV)最先成为辅助化疗的标准方案。FULV组合大幅度地降低了复发率(HR = 0.64, P < 0.0001)1。
约在2000年前后,两个大规模临床实验(MOSAIC2 和 NSABP C-073)证实在FULV的基础上再加奥沙利铂(oxaliplatin)可以进一步降低约5%绝对复发率。目前,由FULV+奥沙利铂组成的联合化疗 (FOLFOX)是结肠癌辅助化疗的标准方案。
虽然FOLFOX作为标准方案被纳入了结直肠癌患者手术后辅助化疗的临床指南,但奥沙利铂却会对90%的患者带来不同程度的急性神经毒性副作用,30%+的患者会遭受永久性神经毒性,带来显著的生活质量下降。此外,治疗奥沙利铂带来的神经病变给医疗系统带来额外负担。在美国,仅缓解神经毒性的后续治疗就需要高达每年1.8万美元的费用。
总体说来,奥沙利铂可以带来的5%的获益率但有90%的毒副作用发生率, 其获益风险比(benefit-risk ratio)对大多数病人不利。
如何最大化奥沙利铂的益处并最小化其毒副作用是消化道肿瘤学中的一个重大课题。近年来,有6个国际合作临床实验曾尝试把FOLFOX的疗程从6个月缩短到3个月,以减少奥沙利铂的用量来降低毒副作用。但短疗程方案对高风险人群无法达到同样疗效。开发生物指标或模型指导奥沙利铂的精准应用是为精准医疗界一个重大课题。
面对奥沙利铂带来的神经毒性问题,鲁兴华教授与团队以人工智能及因果算法为突破口,开展了人工智能临床决策系统对奥沙利铂在指导结肠癌辅助疗效的预测的研究。目前,由陈鲁佳博士为第一作者的该研究以“Machine Learning Predicts Oxaliplatin Benefit in Early Colon Cancer”为题发表在了Journal of Clinical Oncology(IF=45)上。
鲁兴华教授为匹兹堡大学生物医学信息系终身教授。曾任美国国立"大数据到知识"(Big Data to Knowledge)中心癌症项目负责人。鲁教授的课题组主要以人工智能的方法来促进基础研究、转化医学以及临床决策支持,曾获得多项NIH课题资助以及UPMC(匹兹堡大学医学中心)的资助。该课题组由多学科人员构成,其中孙旻教授是在UPMC肿瘤中心的临床医生,陈鲁佳博士是匹兹堡大学的助理教授。
针对本次研究及其影响,鲁教授和团队有着多层的考虑。
一方面是前文所提到极不平衡的收益风险比带来的巨大结直肠癌患者治疗方案创新空间。另一方面则是将人工智能用于指导化疗方面的创新。
众所周知,创新药的研发往往需要消耗海量的资金并经过漫长的时间周期方得以面市。目前的以基因突变标志物指导靶向药物应用的“基因突变指导的精准肿瘤学”(Genome-driven Precision Oncology)的覆盖率较低。化疗药物在绝大多数病人的药物治疗方案中仍占主导地位。鲁教授认为,对已有的化疗药物进行更加精准的临床应用,无疑能更好地发挥已经被验证药物的疗效,尽快提升癌症患者整体的受益率。
带着这些考虑,团队给出了独特的研究方法设计:课题组训练了一个名为COLOXIS(COLon OXalIplatin Signature)的AI模型,用来预测患者对奥沙利铂的反应。他们用公共数据库收集了结肠癌晚期病人对FOLFOX的响应数据并建立了COLOXIS AI模型。临床应用中的生物指标或模型大致可以分为“推测模型” (predictive)和“预后模型”(prognostic)。
前者用于推测一个病人对一种药物的响应及获益,而后者推测患者在相同治疗方案下的不同预后。好的预后可能是疾病本身的生物学特性导致的而并不是由于对治疗药物的获益。在精准医疗的场景中,推测模型是指导用药的唯一方法。
验证一种推测模型需要有用药组和非用药组的数据对比。鲁教授团队同匹兹堡地区的一个专门从事临床实验的科研机构合作,用1065个III期临床试验患者病例验证了COLOXIS模型。这些病例由接受5-氟尿嘧啶+亚叶酸(FULV)治疗的患者(n=421),以及FULV+奥沙利铂(FOLFOX)治疗的患者(n=644)组成。这种用药组(FOLFOX)和对照组(FULV)数据可以用来验证COLOXIS模型能否推测奥沙利铂的疗效。COLOXIS模型将患者分为COLOXIS+(奥沙利铂响应者)和COLOXIS-(非响应者)两组。课题组使用8年无复发生存(recurrence-free survival,RFS)来评估每个组中奥沙利铂的获益,并使用与模型预测和治疗效果之间的交互项(int P)相关的P值来评估COLOXIS模型的预测价值。
在1065名患者中,有526名被预测为COLOXIS+(奥沙利铂响应者),而539名被预测为COLOXIS-(非响应者)。COLOXIS+组的病人显著受益于奥沙利铂(HR=0.65, 95%CI=0.48-0.89, P=0.0065, int P=0.03),而COLOXIS-组的病人则不受益(HR=1.08, 95% CI=0.77-1.52, P=0.65)(图1)。COLOXIS模型能够预测奥沙利铂的效益。

图1 COLOXIS 在大型(N=1065)III期临床试验数据中推测奥沙利铂疗效
COLOXIS的成功源于先进的AI方法。
在筛选参与发病机制的基因的过程中,鲁教授带领团队巧妙地运用了因果分析的方法并推算个体肿瘤对化疗药物的响应。
传统的生物指标模型(譬如Oncotype DX)通常是基于特征值筛选(feature selection)的方法建立的。用特征选择的方法从2万多个基因中找出十几个基因构成一个最佳组合是非常困难的。况且,单基因定量数据噪音较大,此类模型的稳定性往往不甚理想。
现代AI方法(譬如深度学习)多采用特征学习和特征构建(feature learning,feature construction)的方法从数据中学习或构建新的特征值(features)用于下游决策任务。用这类方法可以从数据中找到关键信息并去除噪声。鲁教授团队采用了结合先进的AI因果分析方法和特征值构建的新思路。
复杂的基因突变导致个体间的肿瘤具有极大差异,在不同肿瘤细胞影响不同的信号传导通路,使细胞处于不同状态,进而导致癌细胞对同一药物有不同响应。团队用先进的个体化因果分析方法4缩小搜索范围,寻找哪些基因的表达是受到基因突变的驱动并能够反映细胞内信号通路的功能状态。通过对数据的预筛选,鲁教授课题组将搜索范围从2万多个基因缩小至2000多个,并进一步构建了15个新特征值。最后提高了数据的质量并建立了COLOXIS模型。
COLOXIS模型的成功,在鲁教授和孙教授看来有着多重价值。
对于数量庞大的结肠癌患者群体来说,用药前预测奥沙利铂疗效可以有效避免缺乏响应的过度治疗,并规避不带来疗效的副作用风险。这种通过对治疗方案的优化设计大大平衡了患者在术后所面临的获益风险比(图2)。
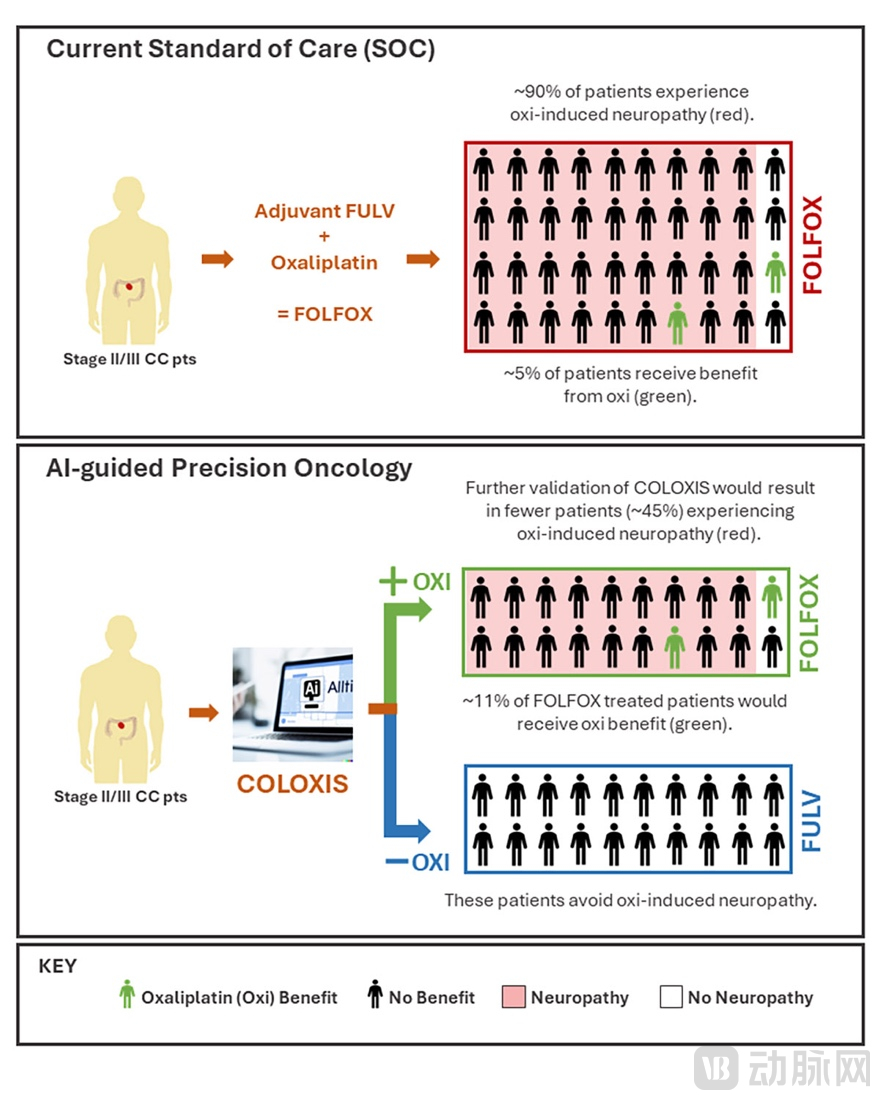 COLOXIS 可以让约半数接受辅助治疗的结肠癌患者避免不必要的奥沙利铂诱发的毒副作用,并大幅度提高总体获益风险比
COLOXIS 可以让约半数接受辅助治疗的结肠癌患者避免不必要的奥沙利铂诱发的毒副作用,并大幅度提高总体获益风险比
另一个更加重要的价值便是,COLOXIS是目前唯一用逾一千病人的大规模的临床试验数据证明化疗药物疗效可以用AI的方法来推算的模型。作为一个用AI指导化疗的先例,COLOXIS的成功证实了用AI指导化疗药物的可行性。
可以想象,在不久的未来,随着更多的AI模型指导不同的化疗药物在临床应用,肿瘤医学将进入一个AI驱动的“后靶向药物”的精准医疗时代:
用AI方法来推测所有FDA批准的抗癌药物(包括靶向和细胞毒性化疗药物)对一个病人的肿瘤的疗效,由医生和病人一起选择“获益风险比最佳”的治疗方案。从这一角度看,COLOXIS的成功是一座划时代的里程碑。
对于未来的精准医疗领域的发展方向,鲁教授和孙教授也有更多思考,认为应该用“以点带面”的方式推进。在让临床医生和监管机构广泛接受AI指导泛癌种泛药物治疗方案前,首先要建立单癌种单药物AI模型的可信性,使之为临床医生和监管部门接受。然后逐渐展开到多个单癌肿单药物AI模型,或泛癌种单药AI模型。
相信在不久的将来,当有足够数据证实以上模型的可信性时,AI在癌症精准医疗的应用最终会被临床医生和监管部门接受。开发这类模型需要有大量的临床和组学数据,以及医院和科研机构的通力合作。
由于FOLFOX治疗方案在多个消化道癌种(食管癌,胃癌,胰腺癌,肠癌)有广泛的应用,COLOXIS模型可以开发成第一个指导泛癌种化疗方案应用的AI模型,为推广AI在癌症精准医疗的应用起到有力的推动作用。该团队正在以产业化途径(DeepRx.ai)进一步开发COLOXIS临床决策系统。
参考文献
1 Wilkinson, N. W. et al. Long-term survival results of surgery alone versus surgery plus 5-fluorouracil and leucovorin for stage II and stage III colon cancer: pooled analysis of NSABP C-01 through C-05. A baseline from which to compare modern adjuvant trials. Ann Surg Oncol. 2010;17(4):959-966. Epub 2010/01/19. doi: 10.1245/s10434-009-0881-y. PubMed PMID: 20082144; PMCID: PMC2935319.
2 Andre, T. et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med. 2004;350(23):2343-2351. doi: 10.1056/NEJMoa032709. PubMed PMID: 15175436.
3 Kuebler, J. P. et al. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP C-07. J Clin Oncol. 2007;25(16):2198-2204. Epub 2007/05/02. doi: 10.1200/JCO.2006.08.2974. PubMed PMID: 17470851.
4 Cai, C. et al. Systematic discovery of the functional impact of somatic genome alterations in individual tumors through tumor-specific causal inference. PLoS computational biology. 2019;15(7):e1007088. Epub 2019/07/06. doi: 10.1371/journal.pcbi.1007088. PubMed PMID: 31276486; PMCID: PMC6650088.


























