1月29日,据HOOKIPA Pharma公告,已收到罗氏决定终止与HOOKIPA共同开发用于治疗KRAS突变癌症的HB-700项目的通知。自2024年4月25日起,HOOKIPA将重新获得HB-700相关知识产权组合的完全控制权,并拥有完全合作和许可权。在此之前,HOOKIPA仍有机会和资格获得与IND提交相关的最终里程碑付款。受合作终止的影响,HOOKIPA将暂停与HB-300相关的开发计划及其大部分临床前研究计划。
该项合作于2022年10月达成,通过合作,HOOKIPA会进行HB-700的研究和早期临床开发,直至Ⅰb期临床试验。在Ⅰb期临床试验完成后,罗氏有权利选择继续负责后续开发和商业化活动。罗氏还拥有获得第二款沙粒病毒癌症免疫疗法的权益。
根据当时的协议,HOOKIPA可获得2500万美元的预付款以及潜在的高达9.3亿美元的里程碑付款,外加HB-700及其他候选产品的全球净销售额中高个位数至双位数的销售分层提成。此外,罗氏有权通过增加一个额外的候选产品来扩大最初的合作,对应的HOOKIPA将在行使期权时获得额外的1500万美元的付款。
根据HOOKIPA公告,HOOKIPA将裁员约30%,并重新平衡其成本结构,未来将优先开发HPV 16+癌症项目HB-200以及与吉利德合作的乙型肝炎、人类免疫缺陷病毒传染病治疗项目。
公告发布后,HOOKIPA盘前交易下跌10%。
罗氏合作项目HB-700尚处于临床前研究阶段
KRAS是肿瘤中最常出现致癌突变的基因之一,也曾经是著名的“不可成药”靶点。2021年5月,安进开发的KRAS G12C抑制剂AMG 510(sotorasib)获上市美国FDA批准上市,打破了KRAS突变40年无靶向药的困局。
然而,sotorasib上市后的表现却不尽如人意,2021年、2022年销售额分别仅有0.9亿美元、2.85亿美元,远低于市场预期。祸不单行,2023年10月,FDA ODAC认为Sotorasib Ⅲ期试验主要研究终点盲态独立中心评估的无进展生存期(PFS)无法被可靠地解释,不能支持其疗效优势,意味着可能面临撤回加速批准或退市风险。
全球第二款获得FDA加速上市的KRAS G12C药物是由Mirati(2023年10月被BMS以48亿美元收购)研发的Adagrasib,但在欧盟的上市申请被EMA建议拒绝,困难显而易见。
实际上,两款KRAS G12C药物 sotorasib与Adagrasib的临床研究数据都不够理想:ORR均在40%左右,PFS中位数改善约6个月,且均显示一定肝毒性。目前,这两款药物的国内权益分别被百济神州、再鼎医药拿下。
罗氏与HOOKIPA的合作项目HB-700是一种用于治疗KRAS突变肺癌、结直肠癌、胰腺癌和其他癌症的研究性沙粒病毒免疫疗法。作为一种复制型双载体疗法,靶向最常见的KRAS突变:G12D、G12V、G12R、G12C和G13D,这些突变体是胰腺癌、结直肠癌和肺癌中最常见的KRAS突变体,占KRAS突变体的74%-95%。这意味着这种免疫疗法可能比单一KRAS突变体抑制剂具有更为广谱的效力。
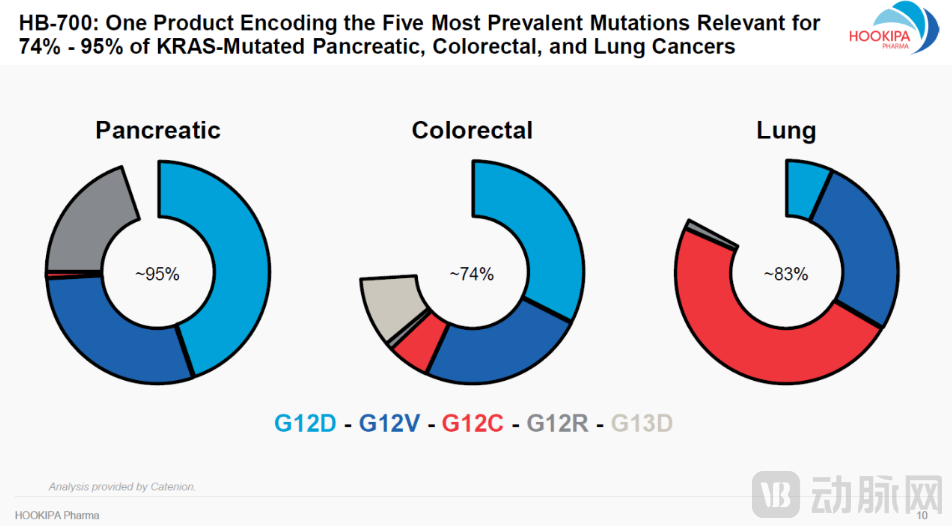 HB-700可以同时表达5种常见KRAS突变体(图源:HOOKIPA官网)
HB-700可以同时表达5种常见KRAS突变体(图源:HOOKIPA官网)
HOOKIPA由1996年诺贝尔生理学或医学奖得主Rolf Zinkernagel博士联合创建,获奖理由是揭示CD8阳性T淋巴细胞如何识别病毒感染细胞方面的研究。在这个研究中,Rolf 使用了沙粒病毒作为研究工具。沙粒病毒是一种RNA病毒,这种病毒的多个特征尤其适合激发人体的抗原特异性免疫反应:
·它通过感染抗原呈递细胞可以激发针对疾病特异性抗原的强力抗体反应
·可以通过重复给药增强免疫反应
·不需要佐剂就能够激活免疫系统
·在临床前和临床试验中表现出良好的耐受性
基于此,HOOKIPA的技术平台利用沙粒病毒表达肿瘤特异性抗原,从而激发人体对肿瘤的特异性免疫反应。根据HOOKIPA的最新公告,HB-700将于2024年第一季度提交IND,于2024年上半年发表临床前研究成果,并寻找新的合作伙伴。
罗氏:旗下基因泰克自研KRAS G12C抑制剂1期试验结果积极
与HOOKIPA的管线合作终止并不意味着罗氏要放弃KRAS赛道,HB-700的表现或许也并不是影响罗氏做出决定的原因。毕竟在2022年罗氏支付过2500万美元的预付款后,后于2023年2月再次支付了1000万美元的非稀释里程碑付款。
事实上,在这次合作开启的同时,罗氏早有KRAS布局。2015年,罗氏KRAS突变诊断获批,其cobas KRAS基因突变检测通过对KRAS基因突变状态的准确识别,帮助医生选择适合患者基因特质的治疗方案,为转移性结直肠癌的靶向治疗提供依据,推进个体化医疗。
2020年,罗氏子公司基因泰克从Relay Therapeutics获得了SHP2抑制剂RG6433的授权许可,并将其推进到临床阶段。SHP2被认为在KRAS的“开”和“关”状态之间发挥着调节作用。
此外,由基因泰克所研发的KRAS G12C抑制剂divarasib(GDC-6036)也于2023年8月在《新英格兰医学杂志》公布了Ⅰ期试验结果。结果显示,divarasib可以在KRAS G12C阳性肿瘤中,产生持久的临床缓解。该药物在非小细胞肺癌(NSCLC)与结直肠癌患者中,分别达到53.4%与29.1%的确认缓解。所观察到大多数的不良事件属于低度。
该试验共招募了137位患者(包含60位NSCLC患者、55位结直肠癌患者、22位其他实体瘤病患)。分析显示,在NSCLC患者中,53.4%的患者观察到确认缓解(95% CI:39.9-66.7),中位无进展生存期为13.1个月(95% CI:8.8-无法估计)。在结直肠癌患者中,29.1%的患者观察到确认缓解(95% CI,17.6-42.9),中位无进展生存期为5.6个月(95% CI:4.1-8.2)。在其他实体瘤患者中也观察到缓解。循环肿瘤DNA的评估发现KRAS G12C变异等位基因频率下降,显示患者可能产生缓解。该研究亦识别出与divarasib耐药性相关的基因组变异。
安全性方面,127例患者(93%)发生治疗相关不良事件;15例患者(11%)发生3级事件,1例患者(1%)发生4级事件。治疗相关不良事件导致19例患者(14%)药物减量和4例患者(3%)停止治疗。
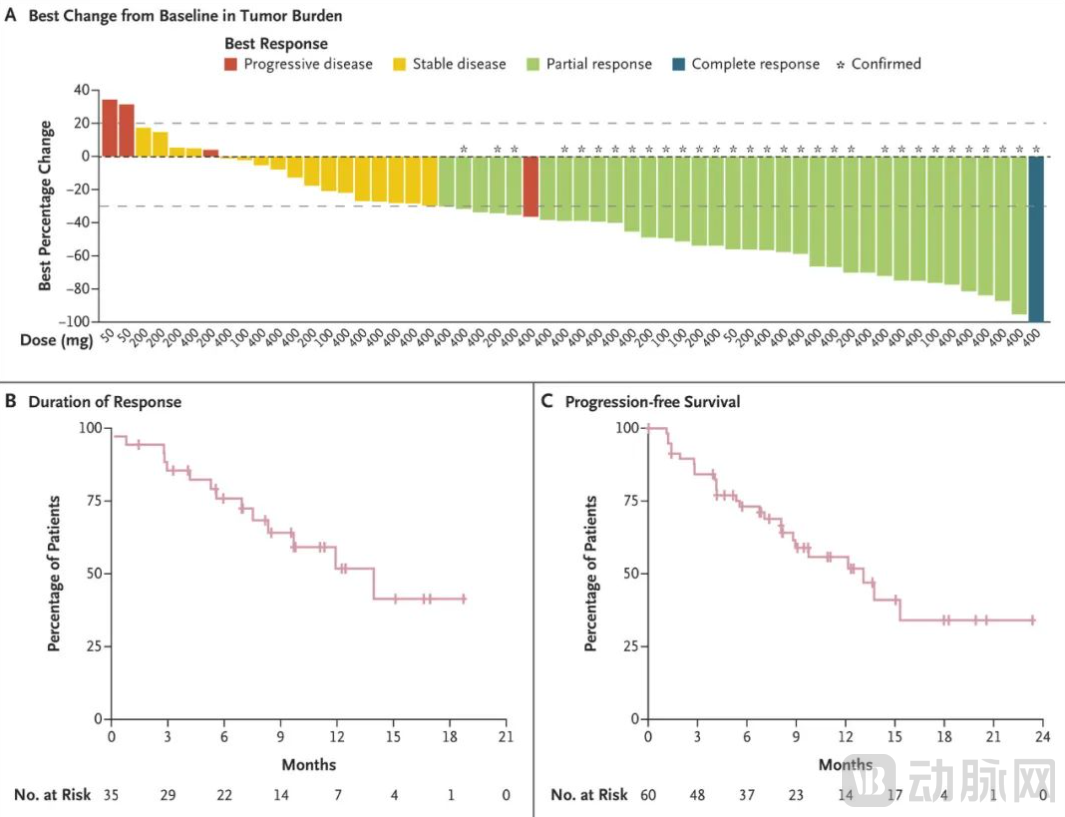 Divarasib治疗NSCLC的试验数据
Divarasib治疗NSCLC的试验数据
从Ⅰ期试验结果来看,Divarasib相较于其他KRAS G12C抑制剂显得更为有效,不过该试验规模较小,病患的种族多样性有限。此外,病患缓解是由研究者而非设盲独立审评所评估,因此目前尚不清楚该药物是否具优效性。根据披露,一项针对非小细胞肺癌(NSCLC)的Ⅲ期试验正在进行中。
据外媒分析,罗氏似乎有更多数据证明,在KRAS G12C抑制剂领域,Divarasib是安进、BMS旗下产品“真正的挑战者”,这可能促使了罗氏放弃继续开发HB-700。
不过,此次终止合作是罗氏在2024年的第二次“瘦身”,或与其2024年的战略规划相关。本月早先时候,AC Immune SA宣布终止了与罗氏集团成员基因泰克和罗氏的合作协议,事关两款阿尔兹海默症项目:anti-Aβ抗体crenezumab和anti-Tau抗体semorinemab。






























