FDA一直试图寻找有效性与安全性间的平衡点。
不久前,FDA就基因编辑药物exa-cel召开咨询委员会(AC)会议时,其讨论的问题就不在有效性,而聚焦在安全性。
exa-cel是否获批FDA的结果还未可知,昨天(11月28日),FDA发布公告,宣布正在调查靶向BCMA或CD19的自体CAR-T疗法是否会在极少数情况下导致患者出现T细胞恶性肿瘤的严重风险。
FDA已经确定,T细胞恶性肿瘤风险适用于目前所有批准的靶向BCMA或CD19的自体CAR-T疗法中。已经收到的不良事件报告显示,T细胞恶性肿瘤已发生在接受该类几种产品治疗的患者中。目前,FDA批准上市的此类CAR-T疗法共六个,具体如下:
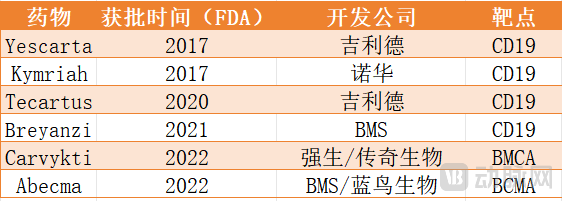 靶向BMCA、CD19的CAR-T疗法 动脉网制图
靶向BMCA、CD19的CAR-T疗法 动脉网制图
整个事情的起因,是FDA收到的来自临床试验和上市后不良事件(AE)数据源中,BCMA、CD19靶向自体CAR-T疗法治疗的患者出现T细胞恶性肿瘤的报告,其中一些严重患者已经住院或死亡。根据FDA FAERS database目前的披露,6款产品共报告了12例T细胞淋巴瘤病例。
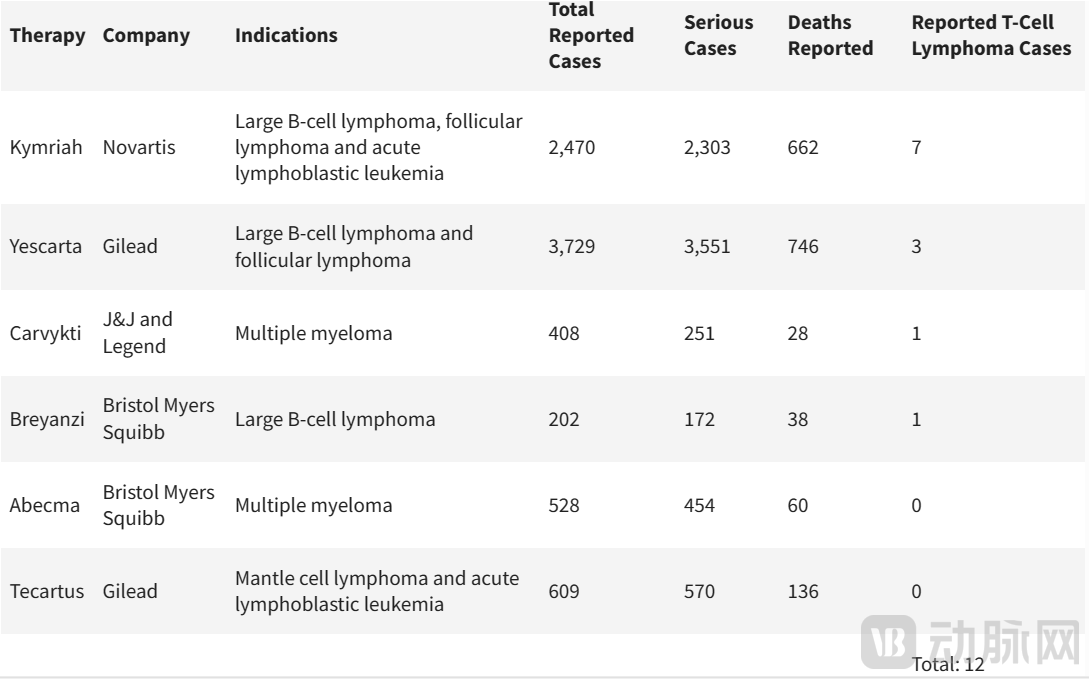 图片来源: William Blair, FDA FAERS database, Fierce Biotech
图片来源: William Blair, FDA FAERS database, Fierce Biotech
FDA表示,尽管这些产品的总体益处继续超过其批准使用的潜在风险,但FDA正在调查已确定的T细胞恶性肿瘤的风险,包括住院和死亡,并正在评估监管行动的必要性。值得注意的是,所有含有整合载体(慢病毒或逆转录病毒载体)的基因疗法产品,包括CAR-T疗法,都被美国处方信息(USPIs)标记为发展二次恶性肿瘤的潜在风险。
根据以往的科学研究,癌症风险很大程度上被认为源于CAR-T疗法递送细胞和基因疗法的病毒载体的不同。在使用CAR-T疗法的治疗中,需要将抽出患者自身的T细胞并进行基因改造,以便能根据特定的靶点(如CD19或BCMA)识别癌细胞,从而达到治疗患者的目的。但问题在于,尽管病毒载体可以传递遗传有效载荷,但当遗传物质被插入人的基因组时,就有可能导致癌症,尤其是在与癌症相关的DNA序列或一致因子附近。纪念斯隆·凯特琳癌症中心的计算免疫学家Caleb Lareau认为,问题可能在于科学家无法精确控制逆转录病毒在基因组中的位置。
因此,根据FDC的上市后要求(PMR),所有细胞疗法制造商需对上市产品进行为期15年的长期随访安全性研究,以评估长期安全性和治疗后发生继发性恶性肿瘤的风险。不过,现在FDA不排除会针对继发性T细胞恶性肿瘤采取更直接的监管行动,但FDA也在公告中强调,获批CAR-T疗法的整体收益仍然大于风险。也就是说,至少目前来看,FDA还不打算撤回任何批准。
受此消息影响,多家CAR-T疗法相关公司股价波动。开发自体CAR-T疗法的Autolus Therapeutics以4.78美元开盘后,跌至3.05美元,收盘回升至4.55美元;CAR-NK疗法开发公司Nkarta全天波动,但仅下跌了约1%;吉利德旗下Arcellx以52.95美元开盘,跌至 48.37 美元,后回升至51.1美元收盘。
而涉及到的拥有靶向BCMA或CD19自体CAR-T疗法的公司,如与强生合作开发Carvykti的传奇生物(Legend Biotech)以61.69美元开盘后最低跌至57.38美元的低点,BMS也从49.99美元跌至48.92美元,吉利德从74.92美元小幅跌至74.51美元。
FDA的公告发布后,诺华、吉利德、BMS等一众企业已对审查给出最新积极回应。
诺华在一份声明中表示,目前Kymriah已被用于治疗超过一万名患者,尚未发现其与继发性恶性肿瘤的因果关系,仍然对其收益-风险特征充满信心。BMS的一位发言人说,该公司正在回应FDA的信息请求,并对其细胞疗法的安全性和临床价值保持信心。强生也表示,已经与FDA分享了Carvykti的治疗后监测数据,并正在与FDA合作评估这一安全信号。
吉利徳表示将完全配合FDA对CAR-T疗法的数据进行额外分析的要求,对Tecartus和Yescarta的整体安全性“充满信心”,因为公司对安全问题进行严格的监控流程,并指出已有17700名患者在临床试验和商业环境中接受了这些产品的治疗。同时补充指出,到目前为止,没有证据表明Yescarta或Tecartus的治疗与新继发性恶性肿瘤的发生有因果关系。
宾夕法尼亚州儿童医院细胞治疗和移植部门负责人Stephan Grupp表示,在宾夕法尼亚大学接受CAR-T疗法的500名患者中,没有一例患上T细胞恶性肿瘤。Grupp同时还认为,FDA公告的真正目的是为了增加自愿报告这些事件发生的可能性,“从理论上讲,其它癌症治疗药也有引发继发性恶性肿瘤的风险,放射、化疗和一些靶向治疗都可能会增加患另一种癌症的风险。”
Raymond James的分析师Dane Leone则在一份报告中提到,FDA对CAR-T疗法的公告可能表明“药物本身正在转化为T细胞淋巴瘤,但FDA并没有对列出的已批准的任何CAR-T疗法进行临床搁置。”
值得注意的是,不久前,BMS和2seventy bio提交的CAR-T疗法Abecma补充适应症申请被FDA推迟,并可能进行咨询小组审查。消息传出后,2seventy bio股价暴跌18%,BMS微跌3.8%。目前尚不清楚是否与此次FDA公告的T细胞淋巴瘤风险相关。
目前我国共批准了三款CAR-T疗法,分别是复星医药合营公司复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液,两者针对的靶点都是CD-19。今年,国内第三款获批的CAR-T细胞疗法伊基奥仑赛注射液由信达生物与驯鹿生物共同开发及商业化,也是国内获批的首款BCMA靶向CAR-T细胞疗法。






























